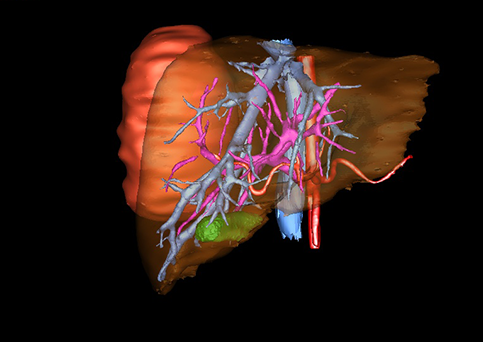
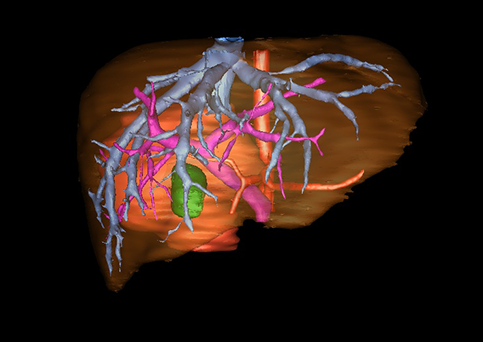
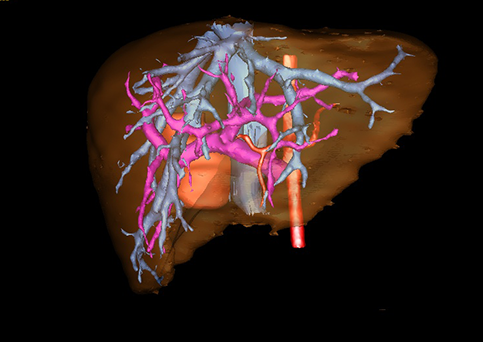
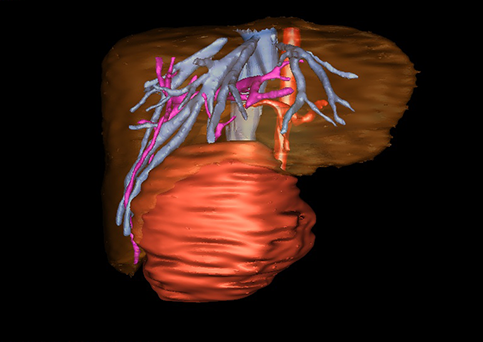
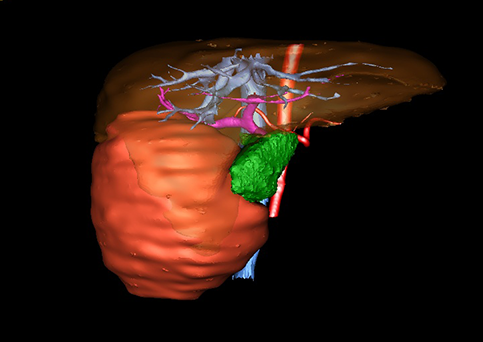
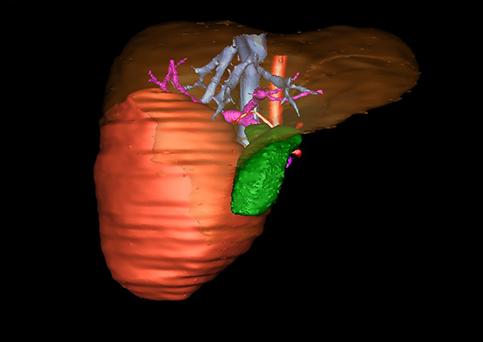
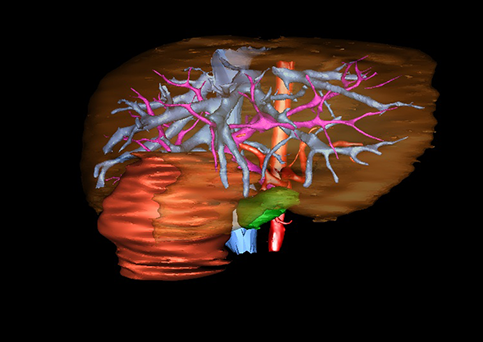
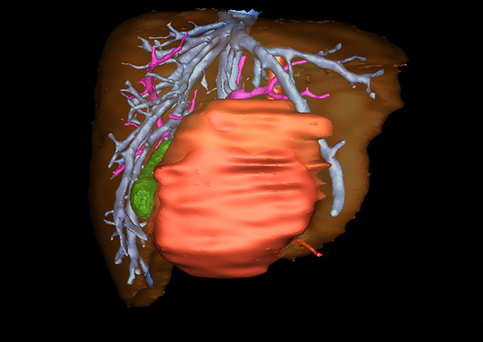
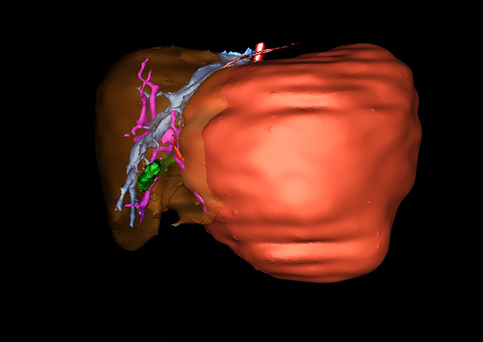
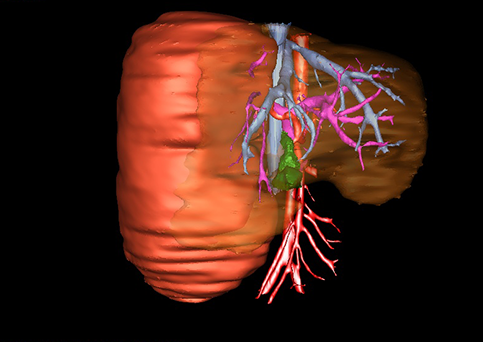
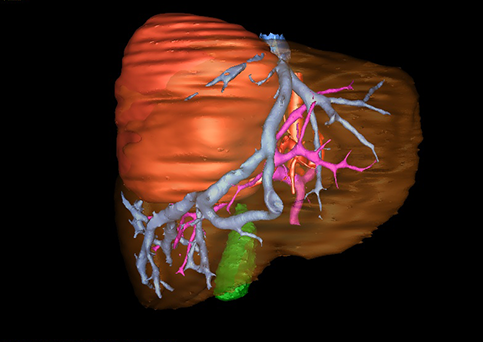
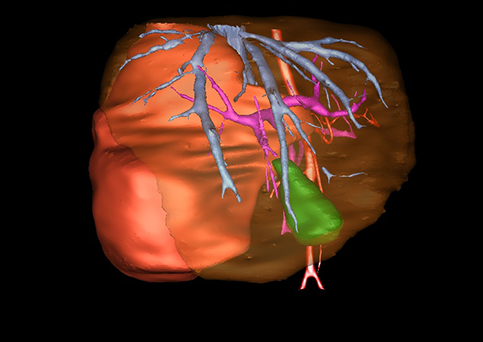
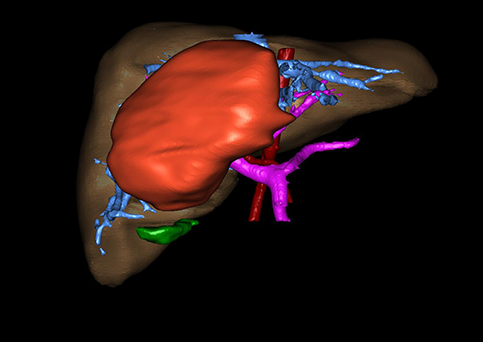
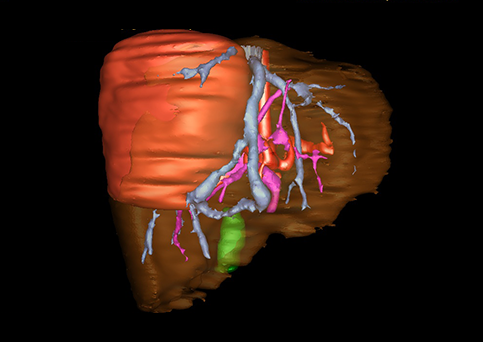
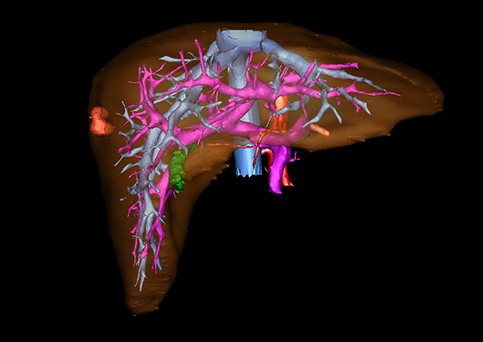
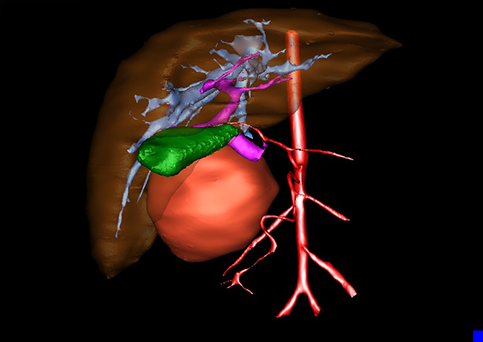
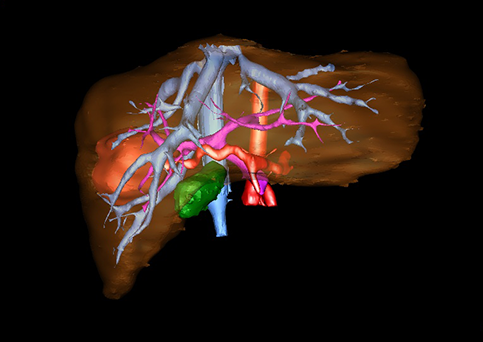
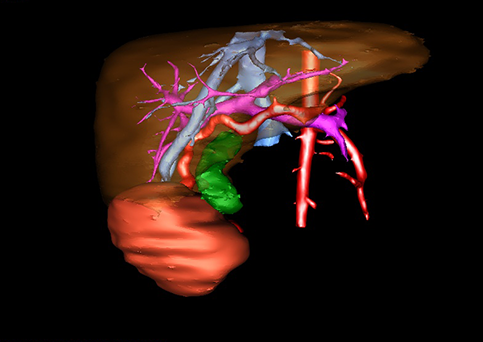
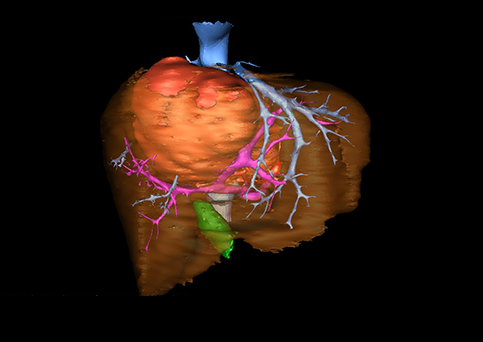
小儿肝脏肿瘤与成人一样,也包涵肝脏原发性肿瘤与继发性肿瘤。小儿原发性肝脏肿瘤约占小儿肿瘤总体发生率的1%~4%,居第10位。其恶性肿瘤则占居全体小儿恶性实体肿瘤的第三位。尽管临床上不十分常见,但当今随着感染性疾病的死亡率下降和先天性畸形的治愈率提高,小儿恶性实体肿瘤已成为儿童的主要病死原因,小儿肝脏肿瘤的诊断、治疗也处于越来越重要的地位。
第一节 概论
一、 小儿肝脏肿瘤发生频度及概况
小儿原发性肝脏肿瘤类型较多,其中良性肿瘤约占全体40%,主要以血管瘤、肝脏错构瘤、肝细胞腺瘤等为主。恶性肿瘤为多,约占60%。常见的为肝母细胞瘤、肝细胞癌、恶性肝脏间叶瘤和横纹肌肉瘤。Greenberg 报告656例小儿的肝脏肿瘤病例的统计分析,肝母细胞瘤占34.6%,肝细胞腺癌占22.5%, 肉瘤为6.8%, 而良性肝脏肿瘤共占36%, 其中以血管瘤为主,占18%。 详见表1、表2。
在全部小儿恶性实体肿瘤中,发生于肝脏恶性肿瘤居第三位或第四位,仅次于神经母细胞瘤及肾母细胞瘤,与恶性畸胎瘤发生率相当,因此是小儿极为重要的恶性肿瘤。近年一组全国范围的小儿恶性肿瘤发病情况及远期治疗结果的调查显示,2年间20家国内大中型医院共收治小儿恶性实体肿瘤426例,其中1997年207例,1998年219例。男性282例,女性144例,男女比例1.96∶1。各种小儿恶性实体肿瘤的发生率顺序为神经母细胞瘤、肾母细胞瘤、恶性淋巴瘤、肝脏恶性肿瘤等。肝母细胞瘤、神经母细胞瘤、肾母细胞瘤、恶性生殖细胞肿瘤等胚胎性恶性肿瘤的发病高峰多在3岁之内。
全国肿瘤防治研究办公室、全国肿瘤登记中心定期收集和发布覆盖地区的全部恶性肿瘤发病和死亡病例。2013年,共收集了全国145个肿瘤登记处的2234万0~14岁儿童数据。结果显示白血病仍位居我国儿童肿瘤发病率和死亡率首位,与全球情况相同。按照发病率排序,之后依次为中枢神经系统肿瘤、淋巴瘤以及来源于骨、肾、肝的恶性肿瘤。
据日本小儿外科学会恶性肿瘤委员会的统计,日本全国每年约有50~100例的小儿肝脏恶性肿瘤的发生,其中肝母细胞瘤与其他肝脏恶性肿瘤的比例为6:1。1岁以下占36%,3岁以下则占全部病例的77.5%,在7、8岁期间有一个小的发病高峰。男女之比约为5:3,与欧美报道的比例类似。
二、 小儿肝脏肿瘤和瘤样病变的分类
小儿肝脏肿瘤按性质可分为恶性肝脏肿瘤与良性肝脏肿瘤,而根据组织学来源可以分为上皮性肿瘤、非上皮性肿瘤、错构瘤、转移性肿瘤和瘤样病变。Malt 1970年将小儿肝脏良性肿瘤分为四类:上皮性瘤、中胚叶瘤、畸胎瘤、瘤样病。上皮性瘤包括肝细胞腺瘤、胆管腺瘤及胆管囊腺瘤。中胚叶瘤包括海绵状血管瘤、毛细血管瘤及婴儿血管内皮瘤。瘤样病包括局限性结节性肝增生、间叶错构瘤及缺氧性假性肝小叶坏死。小儿以肝细胞腺瘤、错构瘤及局限性结节性肝增生较为多见。


第二节 肝母细胞瘤
肝母细胞瘤(hepatoblastoma)是小儿最常见的肝脏原发性恶性肿瘤,在肝脏原发性恶性肿瘤中占50%~60%,占所有的肝脏肿瘤病变的25%~45%。东南亚地区的发病率高于欧洲及北美地区。多见于婴幼儿,尤以生后1~2年发病最多见,3岁以下者占85%~90%。男女之比为3:2~2:1,男性明显多于女性。国内学者曾报道4例先天性肝母细胞瘤,1例为8个月早产患儿因难产出生后即死亡,因肝大行剖检及病理检查证实为肝母细胞瘤,1例生后2天因腹胀、呼吸衰竭死亡,剖检证实。另外2例均因生后发现肝大、腹胀,于生后一个月手术诊断。一组研究提示发病年龄平均1.6岁,1岁以下者占54%,3岁以下者占88%。近10年来国内报道的成人发病病例已经超过10例。
【病因及发病机制】
尽管肝母细胞瘤的详细发病机制尚未完全明了,但一般认为这是一种胚胎性肿瘤。可能是在胚胎发育时期肝脏细胞的增生与分化发生异常,至胎儿期或出生后肝脏内仍存在未成熟的肝脏的胚胎性组织,而这些组织异常的持续增生,形成发育幼稚的组织块而可能转化为恶性的母细胞瘤。这种恶性肿瘤形成的病理过程可能发生于胎儿晚期,也有可能至成人期后才发病,临床上最多见仍为发生于婴幼儿期。
近年来诸多学者进行了不同角度的病因和发病机制的研究,认为其可能与如下的因素有关。
1、染色体异常 在许多小儿的恶性肿瘤中都会见到染色体异常。肝母细胞瘤在11号染色体常有11p 11.5 的杂合子的丢失。11p位点是纯合性突变型等位基因所在,被称为WAGR位点(Wilms’ tumour, aniridia, genital malformation,mental retardation)即与肾母细胞瘤、无虹膜、生殖系统畸形、智力发育迟缓有关,在此位点的异常易发生先天性发育畸形和胚胎性肿瘤。因此临床上常发现合并存在肾母细胞瘤的病例。一组18例肝母细胞瘤的小儿病例,6例显示11p 11.5位点的杂合子的丢失。所有的6例等位基因的缺失均是源于母系的染色体部分,而父系的染色体的相关基因表达正常。也有报道染色体的异常发生在2号和20号染色体的三体型(trisomy 2, trisomy 20),有趣的是这与胚胎型横纹肌肉瘤有类似的染色体异常的表现。
2、遗传因素的影响 大多数病例都是散发的,但也有家族性发病的报道。有学者报告4个家庭中有同胞的兄弟或姐妹发生肝母细胞瘤,其中1对同胞兄弟合并伴有中枢神经系统的异常,1对同时伴有肝糖原累积症1B,而另一对有多发性家族性腺瘤性息肉病的家族史。
3、与低出生体重有关 近年来随着新生儿医疗技术水平的提高,极低出生体重儿的生存率明显提高。但随之发现这些病例发生肝母细胞瘤的比例增加。日本学者提出出生体重低于1000克时,发生本病的危险性大增。日本小儿恶性肿瘤登记中心的资料表明50%的肝母细胞瘤病例出生体重低于1000克。大阪医学中心母子保健研究所的一组报告共5例发生肝母细胞瘤,占所有极低出生体重儿的0.5%。5例的出生体重为 554 ~ 750 克,平均 654 克。为妊娠23~29周的早产。
4、与妊娠期的各种外界不良因素有关 近年有报道发病与母亲的口服避孕药及应用促性腺激素有关。另有研究证实与母亲孕期大量饮酒,导致的胎儿酒精综合征(fetal alcohol syndrome) 有关。
5、肝母细胞瘤发生的可能病程 随着对肝母细胞瘤认识的深入,对其肿瘤发生的可能病程也有了新的认识。尽管有在胎儿期发病的报道,但大部分的发病在婴幼儿时期,甚至有成人发病者。提示胚胎性的幼稚细胞的癌基因是在出生以后由于某些因素的刺激而突变转为初始癌细胞,其发生、发展是一个相对较长的过程。一般认为其发病过程可以分为四个阶段。①原位肿瘤期:从初始癌细胞至临床诊断前期。此时病理可见胚胎性肝细胞、未分化细胞等。AFP等各项临床检查均正常,诊断极为困难。②亚临床期,即典型的临床表现出现以前。此时虽无症状,但AFP、肝脏CT扫描、DSA血管造影检查、MRI、B超检查等均能提示肝脏肿瘤的存在。③临床期,已有症状,肿瘤明显增生,临床分期常在Ⅱ期以上。④晚期,临床分期常在Ⅲ期以上,常有黄疸、腹水甚至远处转移或表现为巨大的肝脏肿瘤瘤体。
从以上的病程来看,其发生、发展都需要一定的时间,了解可能的发病因素,针对高危病例积极进行监测,争取在亚临床期获得早期诊断,对提高治愈率和长期存活率具有重要的意义。
【病理和病理分型】
肝母细胞瘤可发生于肝左叶或右叶,以右叶为多。甚至有发生于肝外的迷走肝组织的肝母细胞瘤,近年有腹膜后或腹腔内其他位置的肝脏外肝母细胞瘤的个案报道。肝母细胞瘤大多表现为肝内单个球形或分叶状融合的实性肿块,常使肝叶变形或移位。肿瘤多呈圆形,半数有包膜,但其包膜多非真性的纤维性组织,而是被肿瘤挤压变扁的一层肝组织。肿瘤表面多有粗大的屈曲、显露的血管。早期为单一的瘤体,后逐渐向周围肝组织浸润、扩张,使肝脏呈结节性增大甚至呈巨大的肿块。笔者进行过多例巨大的肝母细胞瘤手术,瘤体的重量占到体重的8分之一,甚至达到体重的5分之一,此为一例6个月患儿,切除瘤肝1,550克, 而手术前患儿带瘤时体重则为7,800克。
肿瘤切面颜色多样,依胆汁和脂肪的含量而定,分化较好的肿瘤呈淡黄绿色,质地均匀,而低分化的肿瘤瘤体呈白色甚至鱼肉状,常有瘤体内的出血及坏死区域。与成人肝癌有明显的差异的一个特点是小儿病例极少合并肝硬化。小儿肝脏左叶比右叶大,肝脏再生能力远比成人旺盛。这一特点尤以新生儿为甚。小儿在肝脏广泛切除手术后,反应较轻。笔者曾经验1例45天日龄4000克体重的肝脏肿瘤患儿,手术切除450克的右三叶瘤肝,约占整个肝脏体积的80%左右。手术后出现黄疸,但两周自然消退,一月后发现残肝明显增生。
肝母细胞瘤根据其所含组织成分可分为上皮型和混合型。上皮型瘤细胞分化程度从高至低分别是胎儿型、胚胎型和间变型。混合型是在以上皮为主的结构中出现部分间叶成分,常见的是成熟的骨、软骨及骨样组织,偶可见类似纤维肉瘤或肌源性肉瘤的梭形细胞。上皮型较混合型多见。一组24例病例统计中,上皮型22例,其中胎儿型12例,胚胎型7例和间变型3例,3型之间成分有移行现象。2例混合型为大量以胚胎型上皮为主的上皮成分中出现小灶性成熟的软骨和骨样组织。
但对临床病例的大量病理组织学研究发现,并非所有的肝母细胞瘤的组织细胞都似胎儿或胚胎期的肝脏组织细胞形态,以上的分类并不能完全包容所有的病理发现。日本病理学会小儿肿瘤组织分类委员会按照肿瘤组织的分化程度提出高分化型 well differentiated type,低分化型 poorly differentiated type和未分化型 immature type 三类。

图1 位于肝右的叶肝母细胞瘤, 6个月,男婴
1、高分化型肝母细胞瘤 细胞呈立方形或多角形,细胞浆丰富,胞质多为嗜酸性。可见细胞有糖原和胆汁的产生。细胞核呈圆形,核仁量中等,核分裂相较少。细胞形成肝小叶,细胞间时常可见髓外造血或血管湖(vascular lake)。该型相当于胎儿型。
2、低分化型肝母细胞瘤 细胞呈立方形或梭状形,与高分化型相比细胞浆较少,几乎看不到有产生糖原和胆汁的细胞。核仁量较高分化型明显增多,常见核分裂相。细胞不形成肝小叶,肿瘤细胞间结合脆弱。髓外造血少见,但可见到血管湖。该型相当于胚胎型。
3、未分化型肝母细胞瘤 细胞呈圆形或梭状型,有时除了显示上皮性的细胞的排列以外,就细胞形态来讲难以与小细胞的肉瘤相鉴别。细胞浆缺乏,完全没有产生糖原和胆汁的细胞。细胞核仁丰富,核分裂相较少。该型相当于间变型。
【生物学特性与预后的关系】
肝母细胞瘤的预后与组织类型有关,根据组织类型可估计预后,胎儿型最好,其次为胚胎型,间变型最差,混合型则视上皮和间叶成分的分化程度而异。国外报道胎儿型的6年生存率可达71%~100%,而胚胎型则仅为20%~31%。Schmidt等对29例肝母细胞瘤作DNA分析发现,胎儿型常为二倍体,胚胎型和间变型以非整倍体多见,且二倍体预后较非整倍体好。但也有一些学者认为组织类型和染色体倍体都与预后无明显关系。
有学者对24例小儿肝细胞瘤进行临床病理分析和组织学分型,其中18例作7种标记的免疫组化研究,对手术病例进行随访观察。结果:上皮型肝母细胞瘤22例,其中胎儿型13例,胚胎型7例和间变型3例;上皮间叶混合型2例。细胞角蛋白、甲胎蛋白、S-100蛋白和波型蛋白在肿瘤细胞浆的表达分别为14例、10例、9例和4例,癌胚抗原、p53和p16蛋白在肿瘤细胞核的表达分别为11例、9例和7例。手术完整切除肿瘤12例中存活10例,8例生存期超过5年。所有存活病例均为胎儿型。认为肝母细胞瘤可分为若干组织类型,不同类型的免疫表达各异,组织类型和预后有关。对胎儿型肝母细胞瘤,只要早期诊断和完整切除,是可能完全治愈的。2000年至2010年日本儿童肝脏肿瘤研究协会(Japanese Study Group for Pediatric Liver Tumors,JPLT)报道,在212例HB患儿中发现,107例存在CTNNB1基因突变,56例存在CTNNB1基因外显子3的变异;总共约有80%的基因存在突变,其中包括APC基因和Axin蛋白基因。免疫组化显示,β-连环蛋白积聚在Wnt信号畸变的肿瘤细胞中,大多数Wnt的信号靶基因,如细胞周期蛋白D1(cyclin D1),细胞凋亡抑制蛋白(Survivin)和原癌基因(Myc基因)都存在高表达现象。
近年来国外学者对肝母细胞瘤的系列免疫组化研究发现,该肿瘤对CK、AFP、CEA、波形蛋白、S-100蛋白等均出现不同的阳性率。研究发现,肝母细胞瘤上皮成分对上皮标记物阳性表达以CK最高,其次是CEA和AFP,此外尚有S-100蛋白和波形蛋白的表达。AFP在胎儿型的阳性表达高于其他类型,且大多同时伴有血清AFP升高,提示AFP的表达与肿瘤细胞分化呈正相关。相反,S-100蛋白和波形蛋白在胚胎型和间变型阳性表达较高,提示其肿瘤细胞分化呈负相关,这种分化差的细胞具有多方向分化迹象。有研究报告肝母细胞瘤P53蛋白阳性表达率为66%;且以间变型最高,骨和软骨成分也有表达。这一组18例中9例上皮成分细胞核P53阳性,其中胎儿型3例,间变型2例和1例混合型的胚胎型上皮。有关P16蛋白在该肿瘤细胞的免疫表达尚未见报道。本组18例中,细胞核和细胞浆阳性7例,细胞浆阳性10例,包括各种组织类型。
【临床表现】
发病初期多不典型,相当一部分是在家长为患儿更衣或洗澡时偶然发现右上腹部的肿块,后期会出现上腹部或全腹膨隆、恶心呕吐、食欲不振、体重减轻、腹泻、腹壁静脉曲张、发热 、黄疸等表现。因肿瘤迅速增大使包膜张力加大而出现腹部胀痛。部分患儿肿瘤向胸腔方向生长,以至腹部肿块不甚明显,而因肿瘤抬高膈肌主要表现为呼吸困难。
体检时可触及肝脏,呈弥漫性或结节性肿大,瘤块高低不等,质硬。有时伴有脾脏肿大,腹壁静脉显露或曲张。作者曾遇到两例因肿瘤破裂腹痛、腹肌紧张、腹腔穿刺有较多不凝血液而急诊行剖腹探查。晚期病情进展迅速,不久即出现恶病质,另外一个临床特点为常伴有发热,体温可达39~40℃。另有作者报导极为罕见的病例,因肝母细胞瘤的瘤体内含有产生性激素的组织成分,大约3%病例表现性器官发育异常及耻毛出现。典型的肉眼黄疸不常见,但胆红素增高的患儿不少。
另一少见的表现形式是因肿瘤而产生明显的骨质疏松,其机制可能是形成骨基质的蛋白质合成障碍或胆固醇过多,直接影响骨骼的结构所致。以致在较轻微的外力下即可能发生病理性骨折。极个别病例伴有杵状指或半身肥大。
【诊断】
根据病史、临床表现及实验室检查来诊断中晚期病例并不困难,但较难发现早期病例。
1、实验室检查 90~100%的患儿血清甲胎蛋白(AFP)明显增高,对于本病的诊断有特异性的价值,并与肿瘤的增长呈正相关关系,是临床上作为诊断和手术后随访检测的重要指标。其阳性率与肿瘤的组织病理学类型有关,以胎儿细胞肿瘤产生的AFP更多。
另外,血清LDH、胆固醇、碱性磷酸酶也有增高的报道。早期肝功能多正常,中晚期则会出现较明显的肝功能紊乱,
2、 影像学诊断 影像学诊断的目的不是单纯为了获得肝脏恶性肿瘤的诊断,必须在此诊断的基础上明确是单发性的还是多发性的,与周围重要组织器官的关系,有无完全手术切除的可能。
目前常用的检查方法有B超检查、CT、MRI、血管造影等。与其它的腹部肿块的诊断不同,对于小儿肝母细胞瘤血管造影具有重要的意义,可以作为手术前介入治疗的手段,也可为手术提供非常有效的影像学指导,但技术要求高,操作较复杂,且给患儿带来一定的痛苦。近年借助计算机辅助手术系统进行CT原始影像三维重建、手术规划和计算机虚拟手术技术,为精准肝脏手术提供了极为有效的技术支持。
(1)CT表现
1)平扫:可见肝实性肿块,多由数个结节聚合成大块状,其边缘为高或等密度,中心呈低密度或高低不等密度。
2)增强扫描:在动脉期增强可见多个结节状增强染色征象,门静脉期肿瘤呈低密度,中心有不规则更低密度区域,为肿瘤坏死所致。有的肿瘤内含类似骨组织成分,CT 可显示钙化灶。CT平扫示右肝可见巨块状低密度占位性病变,边缘比较光滑,密度不均,内部可见不规则更低密度区域,其内斑点状钙化。增强示肿瘤可见增强,门静脉期肿瘤呈低密度,中心坏死无增强,肝内胆管扩张。

图2:肝右叶肝母细胞瘤的CT表现, 6个月男婴

图3:肝右叶肝母细胞瘤的CT 表现 图4:肝右叶肝母细胞瘤的CT表现

图5:肝左叶肝母细胞瘤合并肝内转移
(2)B超检查
超声检查可明确肿块的部位和性质,区别实质性抑或囊性。可以较好地判断门静脉或肝静脉内是否有瘤栓的存在。另外可以作为是否有肾脏、脾内转移的简便易行的检查手段。
(3)MRI检查
诊断价值与CT相仿。但其三维成像的影像对肿瘤与肝脏血管和周围器官、组织关系的了解具有重要的意义。对于鉴别肿瘤的性质也较CT为好。
(4)其他检查
胸部的X线平片检查可以了解有无肺转移和横膈抬高。肝脏穿刺活检及腹腔镜在诊断不明或肿瘤巨大不能切除者可以应用,以明确诊断、估计肿瘤范围、是否粘连及侵及周围器官、指导手术前化疗用药等。
【鉴别诊断】
1、肝内良性肿瘤 患儿一般情况良好,肿块增长缓慢,血清甲胎蛋白阴性等,一般不难加以鉴别。但对于新生儿及小婴儿的肝脏错构瘤,有时较难鉴别。因正常新生儿血清甲胎蛋白水平即较高,有时通过影像学甚至剖腹探查也难以明确判断。
2 、肝内转移瘤 根据存在原发瘤或有患恶性肿瘤的既往史,容易想到肝内转移瘤的可能,小儿神经母细胞瘤有恶性程度高、转移早的特点,往往原发性肿瘤很小、尚未引起注意时,已出现较大的肝脏转移瘤。根据血及尿中儿茶酚胺的代谢产物的增高,可以获得鉴别。
3、肝脏附近器官的肿瘤 特别是右侧肾上腺肿瘤,甚至肾母细胞瘤,压迫肝脏,使肝脏变薄,肝后面形成陷窝,临床表现及超声检查、CT、同位素扫描所见均类似肝脏肿瘤,必须依靠IVP鉴别。个别肝脏后的腹膜后肿瘤也可出现上述类似肝肿瘤的现象,必须作IVP及钡餐检查,方可鉴别。
【临床分期】
临床分期对于病情的判断、治疗方案的确定和预后估计都有重要的意义。分期、风险因素及预后PR-ETEXT(治疗前疾病进展情况)分期系统是目前对于儿童肝母细胞瘤最常用的分期方法,此方法是由国际儿童肿瘤研究会肝脏上皮肿瘤研究组SIOPEL (Société Internationale d’Oncologie Pédiatrique – Epithelial Liver Tumor Study Group,近年来也称为International Childhood Liver Tumors Strategy Group)提出。该组于1987年在以色列的耶路撒冷SIOP年会期间由小儿外科医生、小儿肿瘤科医生、病理科医生和放射科医生发起成立,致力于儿童肝脏肿瘤(肝母细胞瘤和肝癌)的诊断、治疗、和改善预后的国际合作研究。 自成立以来SIOPEL不断总结国际合作经验,在SIOPEL-1的基础上不断改进小儿肝脏肿瘤的判断标准和治疗原则,目前已经进行到SIOPEL-6的临床试验研究。为小儿肝脏肿瘤的合作研究做出了巨大的贡献。
该分期系统建立的基础是将肝脏分为4个象限,根据B超、CT、MRI等影像学检查结果确定肿瘤的生长范围,肿瘤分期随肿瘤累及的象限数逐渐增加(表3)。运用PRETEXT(Pre-treatment Extent of Disease staging System)术前分期系统与病理活检结果相结合,可有效地指导进一步治疗方案,同时也提示了肿瘤的预后。在过去的10年中,全球各地的许多研究组织都发现了在PRETEXT分期中各种风险因素对于判断HB预后的重要性。
表3 肝母细胞瘤SIOPEL分期及治疗原则
期别 分期表述 治疗原则
Ⅰ期 肿瘤仅累及右后段或左外段 部分肝叶切除或相应部位肝段切除
ⅡA1期 肿瘤累及肝右叶 肝右叶切除
ⅡA2期 肿瘤累及肝左叶 肝左叶切除
ⅡB期 肿瘤累及肝右后段和左外段 相应肝段切除
ⅢA1期 肿瘤累及肝右叶和左内段 超半肝切除或先行联合化疗待肿瘤减量后手术切除
ⅢA2期 肿瘤累及肝左叶和右前段 超半肝切除或先行联合化疗待肿瘤减量后手术切除
ⅢB1期 肿瘤累及肝右叶和左外段 先行联合化疗待肿瘤减量后行相应受累部位的肝切除
ⅢB2期 肿瘤累及肝左叶和右后段 先行联合化疗待肿瘤减量后行相应受累部位的肝切除
Ⅳ期 肿瘤累及左右肝全部四段 联合化疗或放疗后可行肝移植术
注:1、按解剖位置将肝分为左、右两叶和右后、右前、左内、左外四段。
2、各期如有远处转移、肝外浸润及肝脏主要血管受累者应先行联合化疗,根据化疗效果判断是否予以手术治疗。
3、各分期可注明:m远处转移, e肝外浸润,v侵及肝静脉 ,p侵及门静脉。
根据以上判断又分为高危组和低危组二类:
(1)低危组,又称(standard risk HB):单一肿瘤或多发性,肿瘤最多侵犯3个肝段,叫PRETEXⅠ、Ⅱ或Ⅲ。局限在肝内,肺没有转移(肺CT阴性),没有肝外腹部病变,没有肝左、右支门静脉内血管瘤栓者。
(2)高危组(High risk HB):①肿瘤侵犯,4个肝段以上;②证实肝外有肿瘤(转移或肝外腹部结节,左/右门静脉瘤栓形成,主肝静脉瘤栓);③肺转移瘤及远处转移。及腹膜腔内肝门淋巴结肿大病理证实阳性者属高危组患者。
【治疗】
近年来,随着对肿瘤生物学特性了解的深入及化疗和血管介入治疗技术的进步,小儿肝母细胞瘤切除率明显提升,其长期存活率有了明显的提高。目前,手术切除配合正规的化疗,该症的两年存活率已达80%以上。
目前,手术完整地切除肿瘤仍是最重要、最有效的治疗手段。现代治疗原则应为根治性切除肿瘤,确保肝功能的有效代偿,达到治愈或延长生存期提高生存率的目的。许多以往被认为无法手术切除的病例,现在可以通过术前化疗及介入治疗使肿瘤缩小,正常肝脏相对增大,而变为可以手术治疗。
表 26-4 肝母细胞瘤的治疗方案
可一期手术切除病例
肝脏肿瘤切除——手术后化疗持续6~8月
不能一期手术切除的巨大肿瘤病例
手术前化疗5~6个疗程(约4~6个月)后,肿瘤缩小——进行延期手术切除肿瘤
或合并应用肝动脉选择性栓塞术,甚至选择性门静脉栓塞术约4~6个月后,肿瘤缩小、正常肝组织代偿性增大——进行延期手术切除肿瘤
肿瘤巨大弥漫至全肝或侵犯严重,无法手术切除病例
积极准备,实施原位肝移植。
一、可一期手术切除病例的治疗
肝脏的局部解剖和肝脏肿瘤切除后肝功能的代偿是肝脏肿瘤手术的关键问题。通过手术前的各种影像学检查,了解肿瘤的部位、范围、比邻关系,特别是肝脏血管的受侵情况。有经验的小儿肝胆的外科医生往往可以大体估计出肿瘤可否安全地一期切除,并且残留的肝脏能否维持机体的基本需要。作为有价值的影像学检查手段,肝脏的血管造影对手术可行性的判断具有重要的意义。如果无法进行肝血管造影,笔者认为增强的CT检查是必须的,也是十分有效的。增强CT可以更清晰地看出肿瘤的界限,特别是根据动脉相和静脉相的不同,判断出肿瘤与门静脉及肝静脉的关系以在手术前较准确地估计出手术成功切除的可能性。笔者近年成功切除十余例巨大的小儿肝脏肿瘤,最重的瘤体达4.8千克,另一例瘤体比例最大的5个月患儿肿瘤重量占身体重量1/5。
1、术前准备 早期的患儿,一般情况较好,只进行简单的常规术前准备即可进行手术。但对于本病患儿往往一般情况较差、存在营养不良、低蛋白血症等,应尽早地进行静脉营养支持,并给予维生素K等。
2、手术切除 小儿肝母细胞瘤瘤体往往较大,切除的比例常远大于成人。但小儿肝脏再生能力强,有人报告,只要保存20%以上的正常肝组织就能维持生命,而且在2个月内再生后的肝脏可恢复到原来的体积,因此应积极争取肿瘤全部彻底地切除。
手术中根据肿瘤的大小、部位选择术式,可以视情况进行肿瘤切除、肝叶切除、半肝切除或扩大的肝脏多叶切除。对于多例巨大的肝脏肿瘤,笔者先精细解剖第一、第三和第二肝门,预先完全处理相关的门静脉分支、二、三级肝动脉、肝短静脉、肝静脉及胆管,然后阻断第一肝门开始切除肿瘤。近年进行的十余例无一例手术中死亡,均平安度过围手术期。这一手术方法给一些原本无法手术的巨大肝脏肿瘤患者带来新希望。
过去片面强调手术彻底切除肿瘤,在切除肿块的边缘镜下找不到瘤细胞。近来主张,能安全地彻底切除者,可作彻底切除,否则只作姑息性的大部分肿瘤切除,遗留不多的肿瘤组织,术后辅以化疗,可能长期存活。
3、术后治疗 手术后特别是术后2周内,必须供给患儿足够的营养,包括绝对需要的蛋白质、维生素和能量的供应。
手术后的化疗,配合综合治疗对于小儿的肝脏恶性肿瘤尤为重要。化疗药物,如长春新碱、环磷酰胺、5-氟尿嘧啶都有一定的抗肝癌的作用。阿霉素对抗肝细胞癌及肝母细胞瘤的效果较好,但副作用大。国外有人报告,对肉眼观察已完全切除,镜下仍遗留瘤组织 者,术后进行化疗,有35%存活。目前多主张施行多方案联合、交替用药的方法进行。也有配合进行造血干细胞移植或骨髓移植者。
二、不能一期手术切除的巨大肿瘤的处理
部分晚期患儿往往一般情况差、肝功明显不良、肝脏肿瘤巨大,无法一期手术切除。对此类患儿建议先行开腹探查活检,以明确诊断。或对于血清甲胎蛋白极高、诊断明确者,可以进行术前化疗或者介入治疗配合化疗。经如此术前治疗后,肝内肿瘤会明显缩小,而正常肝脏相对增大,可以进行较彻底的肿瘤切除。
小儿恶性实体肿瘤具有发展迅速、转移较早等临床特点,半数以上患儿就诊时已有邻近组织、区域淋巴结、甚至经血运远处转移。而在治疗上,手术切除辅助化疗仍是目前我国小儿恶性实体肿瘤的主要治疗方法,随着术前化疗,血管阻断控制出血等技术的应用,肿瘤完整切除率已近70.0%,其中肝脏恶性肿瘤的完全切除率达75.0%。术前术后的辅助化疗已广泛开展,对控制转移播散、杀灭微小病灶、保存肢体器官、维持生理功能和提高生存率均有积极意义,但有部分病例不能坚持全程化疗,治疗不规范不容忽视。
三、不能切除的肝母细胞瘤的肝移植治疗
儿童原发于肝脏的恶性肿瘤中, 肝母细胞瘤和肝癌估计要超过98%。 许多肿瘤通过术前化疗和延迟手术能很好控制, 局限的肿瘤行一期切除原发肿瘤。 85%以上的肝脏能安全切除, 术后3~6个月肝脏能完全再生。 不能切除的两叶多发肝脏肿瘤、 血管受侵犯、 包绕肝门及主要管道、 肝脏肿瘤复发的病例可施行肝移植。原发性和转移性肝脏肿瘤, 如肝母细胞瘤、上皮样肝血管内皮瘤、 肝癌、 纤维肉瘤等适合作肝移植手术。
随着人体组织器官移植技术的进步,肝移植也逐渐应用到不能手术切除的小儿肝母细胞瘤的治疗中。一组报道5例不能切除的肝脏肿瘤而行肝移植手术, 男3例, 女2例。 所有病例在手术时均无肝外转移病灶。2例年龄分别为3岁和6岁之肝母细胞瘤患儿。血清AFP明显升高, 经B超和CT证实, 1例为多发性肝脏肿瘤, 另1例为右叶肿瘤伴门静脉栓塞, 分别行部分及全肝移植。 1例术后曾发生肝动脉栓塞、 肝脓肿、 胆道阻塞和胆汁淤积。至肝移植术后37和25个月时两患儿均健康并已上学。 1例2.9岁女孩患肝血管内皮瘤, 病变侵占左右肝叶及胆管。 术前用大剂量激素治疗无好转, 肿瘤迅速增大而行全肝移植。术后29个月发现脊柱转移再行椎板切除术,于肝移植术后41个月, 转移病灶切除术后12个月死于多发性转移。2例分化中等的肝细胞癌患儿分别于移植术后8个月和5个月因转移肿瘤复发而死亡。
【手术并发症】
肝脏是人体最大的实质性器官,血液丰富,胆管与血管交错,是解毒及合成、分解和储藏营养物质的主要器官。手术设计和操作稍有疏忽,就可能危及生命。在术中及术后应注意可能发生以下较紧急的情况:
1、出血 规则性肝脏切除术,尤其是不规则的肝脏切除术出血量多,意外损伤各类血管时出血量更多。大出血是术中和术后不久死亡的主要原因。输血量不足或过多,输血速度太慢或超心脏负荷的输入速度太快,都可引起致死的循环紊乱。近十几年来,国内外都在探索用隔离灌注、暂时性阻断肝动脉及门静脉等方法,可望减少手术出血,但经验尚不成熟。输入大量的库存血,未适时适量补充钙,可发生枸橼酸钠毒性反应,患儿出现抽搐、血压下降、心率不整,以致心跳骤停。
2、心跳骤停 搬动或牵拉肝脏、扭曲下腔静脉而突然减少回心血量,致血压剧降,心跳骤停。搬动肝脏也可引起反射性呼吸急促,血压下降、心率变慢,心音低钝,终致心跳骤停。肝脏手术时,强调术者操作轻稳和麻醉者的仔细观测,一旦出现上述现象,立即暂停手术,置肝脏于原位,积极对症处理,在度过险情后再继续手术。
3、气栓 较常见。肝静脉破裂,特别是下腔静脉破裂,易吸入空气,形成气栓,可致心跳骤停。手术操作精确无误,是预防气栓形成最有效的措施。使用正压呼吸,可减少空气进入静脉破口的量及速度。
4、术后肝昏迷 是保留的正常肝组织太少,或误认已有硬变的肝为正常的肝组织,予以保留的后果。仅个别轻昏迷者在对症治疗、肝组织再生后可望存活。多数在术后不久死亡。
5、术后黄疸 有人报告,作右三叶肝切除术后常出现黄疸,只要残存的10-30%的左外叶肝组织迅速增生,黄疸可在术后不久消失。如果误扎或误断被肿瘤挤压移位、变形的肝管,则黄疸进行性加重。笔者曾成功手术治疗1例45天日龄4000克体重的肝脏肿瘤患儿,手术切除450克的右三叶瘤肝,约占整个肝脏体积的80-85%左右。手术后出现黄疸,但两周自然消退。现术后1年,生长发育与同龄小儿相比完全正常。
6、低体温 与环境温度低及输入大量库存血有关。近来用半导体测温计,随时观测体温及注意保温,大龄小儿术后低体温已不多见,但小婴儿及新生儿则多见,应引起高度重视。
第三节 肝细胞癌
肝细胞癌(hepatocellular carcinoma, hcc)在小儿时期很少见,这与成人有很大的不同, 该病在我国成人是最常见的恶性肿瘤之一,尤以东南沿海地区为多见。对于小儿肝细胞癌的认识则经历了较为复杂的过程,1967年Ishak和Glunz对小儿恶性肝细胞瘤进行深入研究后才把肝母细胞瘤和肝癌区分出来,认为小儿期的肝细胞癌与肝母细胞瘤不论是病理学还是临床表现都不尽相同,应作为一独立的疾病。
【病因】
肝细胞癌的发病原因和发病机理,至今仍未明了。可能与慢性肝病,如慢性乙型肝炎,丙型肝炎,肝硬变;某些天然化学致癌物质,如亚硝胺类化合物,有机氯杀虫剂等;以及其它因素,如肝内寄生虫感染、营养不良、遗传等有关。很多肝细胞癌病人存在慢性肝病的历史,例如高酪氨酸血症继发肝纤维化或肝硬化,氨甲喋呤诱发肝纤维化,家族性胆汁淤积性肝硬化、人血清中α-1抗胰蛋白酶(α-1Antitrypsin)缺乏、胆道梗阻等病人最后常常继发肝癌的发生。
在我国,乙型肝炎病毒感染和肝癌的关系是个较突出的问题。在肝癌细胞DNA内也发现有整合的乙型肝炎病毒片段。许多学者认为对于儿童病例同样也存在这样的问题,北京儿童医院曾报道5例小儿肝癌全部做了乙型肝炎病毒表面抗原检测,结果有4例在肿瘤周围的肝细胞和肿瘤细胞内发现乙型肝炎病毒表面抗原。与肝母细胞瘤相比,70例肝母细胞瘤中,仅1例胚胎性肿瘤病人的肿瘤组织和肝组织内乙型肝炎病毒表面抗原阳性。以上材料说明许多对肝脏有害的因素包括乙型肝炎病毒感染与肝癌的发生有一定关系。一般认为HBV病毒感染后发生肝细胞癌的潜伏期是20年,可是在小儿病例6~7年后则可发展成为肝细胞癌,但其确切的发病机理尚待进一步的研究。
有报道小儿慢性遗传性高酪氨酸血症(hereditary tyrosinemia)病例如果能够长期生存,其肝细胞癌的发生率明显增高。一组43例中生存两年后16例发生肝细胞癌,所有病例伴发肝硬化。提示肝硬化因素早于肝癌的发生。另有报道肝细胞癌伴有神经纤维瘤病、运动失调性毛细血管扩张症和家族性多发性腺瘤病。
【病理】
多数肝细胞癌病例,在确诊时肿瘤已经广泛扩散,有些为多中心病灶或弥漫浸润肝的左右叶,偶尔也可见有孤立的界限清楚的瘤块。肿瘤呈灰白色,有些病例由于肿瘤生成胆汁,因此呈淡黄绿色,肿瘤呈结节状或弥漫浸润肝实质,很少形成假包膜。肿瘤结节内常见出血和囊肿形成。肿瘤以外肝组织可见肝硬化。
镜下表现,肿瘤细胞呈多边形,体积大,核大且有明显的异形性。核仁大而突出,嗜伊红染色或嗜双色染色,核染色质丰富而粗糙,向核膜聚集,核膜与核仁之间形成空晕,使细胞核形态类似核内包涵体,核分裂像很常见。胞浆丰富粉染,有时可见瘤巨细胞。瘤细胞排列成很粗的索状或巢状,有些区域呈腺管状排列,类似胆管癌。多无髓外造血,肿瘤周围可见肝硬化。肝的再生结节有时还可看到肝细胞向瘤细胞转化,血管浸润很常见。在分化好的肝细胞癌需要和肝腺瘤鉴别。细胞的异形,较多的核分裂像和血管的浸润是诊断肝细胞癌的重要标志。
原发性肝癌的大体标本通常可分为三型;即巨块型、结节型和弥漫型。巨块型为单个癌块或多个癌结节融合而成,多见于肝右叶,较少伴发肝硬化,手术切除的机会较多,预后亦较好。但由于癌块的迅速生长,易发生中心部位的坏死、出血,在临床上可有破裂出血等并发症。结节型最为常见,为多个结节性癌灶,大小不一,分布广泛,有半数以上病例波及全肝,大多伴有较严重的肝硬变,手术切除率低。弥漫型最少见,为广泛分散。
【临床表现】
发病年龄较肝母细胞瘤晚,大部分在5岁以后发病,但也有报道在婴儿时期发生肝细胞癌,男性较女性多见,为1.7~11∶1。一组5例肝细胞癌的的报道病例,发病年龄在8~13岁,全部为男性,多数病人存在原发的慢性肝脏病变。
1、早期症状 肝细胞癌的早期症状较为隐匿,表现无特征性。可有上腹部不适、胀痛、刺痛、食欲下降,无力和伴有进行性肝肿大。对可疑患者,应用甲胎蛋白检查普查,可发现一些“临床前期”的患者,为早期手术切除“小肝癌”和术后长期存活,提供了可能。
2、主要症状 肝区痛为最常见症状,因癌瘤使肝包膜紧张所致。多为胀痛、钝痛和刺痛;可为间歇性,亦可为持续性。病变侵及横膈或腹膜后时,可有肩背或腰部胀痛;肝右后上部的侵犯亦可有胸痛。初为上腹胀,尤多见于左叶肝癌,另外,消化功能障碍及腹水亦可引起腹胀。食欲不振也很常见,亦常有恶心,呕吐及腹泻。肝肿块为中、晚期肝细胞癌最常见的主要体征,约占95%。肝肿大呈进行性,质地坚硬,边缘不规则,表面凹凸不平呈大小结节或巨块。癌肿位于肝右叶顶部者可使膈肌抬高;肝浊音界上升。在不少情况下,肝肿大或肝区肿块是病人自己偶然扪及而成为肝癌的首发症状的。肝肿大显著者可充满整个右上腹或上腹,有季肋部明显隆起。
部分病例可以表现为某些全身性综合征,是癌组织产生某些内分泌激素物质所引起,如低血糖症,红细胞增多症,类白血病反应,高血钙症等。

图6:示肝门部肝细胞癌的手术中所见,女,15岁

图7:示肝门部肝细胞癌的手术中所见,男,3岁
【诊断】
检查方法及手段与肝母细胞瘤相同。肝细胞癌出现了典型症状、体征,诊断并不困难,但往往已非早期。所以,凡是有肝病史的病人,如有原因不明的肝区疼痛、消瘦、进行性肝肿大者,应及时作详细检查。采用甲胎蛋白(AFP)检测和B型超声等现代影像学检查,诊断正确率可达90%以上,有助于早期发现,甚至可检出无症状或体征的极早期小肝癌病例。为早期手术切除“小肝癌”和术后长期存活,提供可能。
1、定性诊断
(1)血清甲胎蛋白(AFP)测定 本法对诊断肝细胞癌有相对的专一性。如AFP对流免疫电泳法持续阳性或定量>500μg/L,并能排除活动性肝病、生殖腺胚胎性肿瘤等,应考虑为肝脏恶性肿瘤,肝母细胞瘤与肝细胞癌均可表现为显著增高。
(2)血液酶学及其他肿瘤标记物检查 肝细胞癌病人血清中的谷氨酰转肽酶、碱性磷酸酶和乳酸脱氢酶同功酶等可高于正常。此外,病人血清中5'-核苷酸磷酸二酯酶,a-抗胰蛋白酶,酸性同功铁蛋白,异常凝血酶原等的阳性率亦较高。但由于缺乏特异性,多作为辅助诊断。
2、定位诊断
(1)超声检查 采用分辨率高的B型超声显象仪检查,可显示肿瘤的大小、形态、所在部位以及肝静脉或门静脉内有无癌栓等,其诊断符合率可达84%,能发现直径2cm或更小的病变。是目前有较好定位价值的非侵入性检查方法。
(2)放射性核素肝扫描 应用198金、99m锝、131碘玫瑰红、113m铟等玫瑰红、113m铟等进行肝扫描,常可见肝脏肿大,失去正常的形态,占位病变处常为放射性稀疏或放射性缺损区,对肝癌诊断的阳性符合率为85~90%,但对于直径小于3厘米的肿瘤,不易在扫描图上表现出来。采用放射性核素发射计算机体层扫描(ECT)则可提高诊断符合率,能分辨1~2cm病变。
(3)CT检查 可检出直径1.0cm左右的早期肝癌,应用增强扫描可提高分辨率,有助于鉴别血管瘤。对肝癌的诊断符合率可达90%。另外,对于无条件进行肝动脉造影的病例,根据CT增强扫描的肝动静脉影像可以判断肝脏血管受侵及的程度,为指导手术具有重要的参考价值。

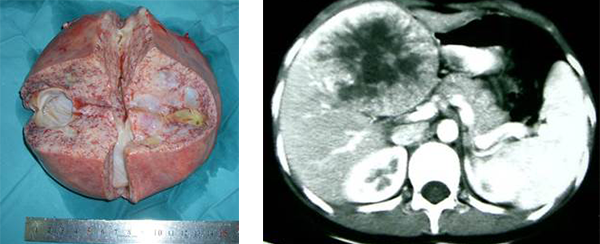
图8:示肝细胞癌的CT所见,女,15岁
(4)选择性肝动脉造影检查 对血管丰富的癌肿,其分辨率低限约lcm,对<2.0cm的小肝癌其阳性率可达90%,是目前对小肝癌的定位诊断各种检查方法中最优者。
(5)磁共振成像 (MRI) 诊断价值与CT相仿。但其三维成像的影像对肿瘤与肝脏血管和周围器官、组织关系的了解具有重要的意义。
【鉴别诊断】
下列疾病应与原发性肝癌鉴别:
1、肝硬变 病程发展缓慢,肿大的肝脏仍保持正常的轮廓。超声波检查,放射性核素扫描和血清α-FP测定,有助于鉴别。但当肝硬变的肝脏明显肿大,质硬而呈结节状;或因肝脏萎缩,硬变严重,在放射性核素肝扫描图上表现为放射性稀疏区时,鉴别不易。应密切观察,并反复测定血清α-FP以作动态观察。
2、继发性肝癌 病程发展相对较缓慢;血清α-FP测定多为阴性。主要鉴别方法是寻找肝脏以外有无胃肠道、泌尿生殖系统、呼吸系统、乳腺等处的原发性癌肿病灶。
3、肝脓肿 一般都有化脓性感染或阿米巴肠病病史和寒战发热等临床表现。肿大肝脏表面无结节,但多有压痛。超声波检查肝区内有液性暗区。
4、肝包虫病 多见于我国西北牧区。右上腹或上腹部有表面光滑的肿块,病人一般无明显的自觉症状。肝包虫皮内试验阳性可资鉴别。
此外,还须与肝脏邻近器官,如右肾、结肠肝曲、胃、胰腺等处的肿瘤相鉴别。
【治疗】
治疗原则:早期发现、早期诊断及早期治疗并根据不同病情发展阶段进行综合治疗,是提高疗效的关键;而早期施行手术切除仍是最有效的治疗方法。 对于肿瘤巨大,无法一期手术者,应用化疗、肝动脉栓塞化疗、放疗等术前治疗,使癌肿缩小正常肝脏增生,变不可手术为可手术也是一重要的手段。对无法手术的中、晚期肝癌,可根据病情采用中医中药治疗,化疗、冷冻治疗,肝动脉栓塞化疗等。
1、手术治疗
(1)手术切除主要适用于癌肿相对局限,无严重肝硬变,肝功能代偿良好,癌肿未侵犯第一、第二肝门及下腔静脉,以及无心、肺肾功能严重损害者。
术式的选择应根据病人全身情况、肝硬变程度、肿瘤大小和部位以及肝代偿功能等而定。癌肿局限于一个肝叶内,可作肝叶切除;已累及一叶或刚及邻近叶者,可作半肝切除;已累及半肝,但没有肝硬变者,可考虑作三叶切除。位于肝边缘区的肿瘤,亦可根据病变情况选用肝段或次肝段切除或局部切除。肝切除手术中一般至少要保留正常肝组织的25~30%。
(2)对不能切除的肝癌的外科治疗。可根据具体情况,采用肝动脉结扎、肝动脉栓塞、肝动脉灌注化疗、液氮冷冻、激光气化、微波热凝等单独或联合应用,都有一定的疗效。肝动脉结扎,特别是肝动脉栓塞术合并化疗,常可使肿瘤缩小,部分病人可因此而获得二期手术切除的机会。
(3)肝癌破裂出血的病人,可行肝动脉结扎或填塞止血,如全身情况较好;病变局限,在技术条件具备的情况下,可行急诊肝叶切除术治疗。对出血量较少,血压、脉搏等生命体征尚稳定,估计肿瘤又不可能切除者,也可在严密观察下进行输血,应用止血剂等非手术治疗。
原发性肝癌也是行肝移植手术的指征之一,影响远期疗效的主要问题还是肝癌复发。
2、 化学药物治疗
(1)全身化疗:多通过静脉给药。目前常用的药物为:5-氟尿嘧啶、阿霉素、丝裂霉素、噻替哌、氨甲喋呤、5-氟尿嘧啶脱氧核苷及口服喃氟啶等。但疗效逊于肝动脉灌注等用药。
(2)肝动脉插管化疗:经手术探查,发现已不能切除者,可经胃网膜右动脉或胃右动脉作肝动脉插管。常用5-氟尿嘧啶、噻替哌等药,每日或隔日经导管灌注一次。
3、 肝动脉栓塞治疗
常用为经皮穿刺股动脉插管到肝固有动脉,或选择插管至患侧肝动脉进行栓塞。常用栓塞剂是碘油和剪成小片的明胶海绵。近年来多加入化疗药物,二者联合应用效果更好。此法可反复多次施行,以提高疗效。目前认为肝动脉栓塞化疗是非手术治疗的首选方法,同时也可以作为巨大肝细胞癌手术前治疗的有效方法。
4、放射治疗
对一般情况较好,肝功能尚好,不伴有肝硬变,无黄疸、腹水,无脾功能亢进和食管静脉曲张,癌肿较局限,尚无远处转移而又不适于手术切除者,可采用放射为主的综合治疗。
5、局部注射无水酒精疗法
在B型超声引导下经皮穿刺肿瘤注射无水酒精,可使肿瘤脱水、凝固,坏死。适用于瘤体较小而又不能手术切除者。一般需要重复注射数次;此法较简便、费用低。此外,也可选用5-氟尿嘧啶、丝裂霉素等抗癌药物注入肿瘤内。
6、 免疫治疗及支持疗法
常用的有卡介苗、自体或异体瘤苗、免疫核糖核酸。转移因子、干扰素、白细胞介素-2、左旋咪唑等,但疗效尚欠肯定,多在探索之中。另外可以根据不同病情采取辨证施治、攻补兼施的中药治疗方法,常与其他疗法配合应用。以提高机体抗病力,改善全身状况和症状,减轻化疗、放射不良反应等。 以上各种治疗方法,多以综合应用效果为好。
第四节 肝脏和胆管的横纹肌肉瘤
横纹肌肉瘤(rhabdomyosarcoma of the liver and biliary tract)是来源于将要分化为横纹肌的未成熟的间叶细胞。这些间叶细胞属于骨骼肌谱系。但也可以起源于一些原本并没有横纹肌的组织或器官,例如膀胱、子宫及胆道等。发生于肝外或肝内胆道系统的恶性肿瘤非常少见,在这些极其少见的肿瘤中,则以胚胎型横纹肌肉瘤最常见。
【病理】
肝胆横纹肌肉瘤起源于肝内外胆管。大多为胚胎型和葡萄状肉瘤亚型。肿瘤发生部位可以从乏特氏壶腹直至肝内小胆管。肿物可位于肝内或胆管内,肝内外胆管肿瘤发病数为1∶4~5。发生于较大胆管的肿瘤有些可以看到葡萄状肉瘤的特点。肿瘤可以堵塞管腔,引起总胆管的扩张和出现梗阻性黄疸。发生在肝内小胆管的肿瘤则形成肝内肿块常常找不到胆管发生的特点。
病理表现:位于胆管内的肿瘤可以看到多数表面发亮的黏液样息肉,突向管腔,常见出血、坏死和管腔内化脓性改变。镜下:肿瘤表现有黏膜覆盖,紧贴黏膜可见染色很深的小椭圆形至梭形细胞形成的密集层,这就是所谓的新生层(Cambium layer),但不是所有的胚胎型横纹肌肉瘤都能找到这种典型改变,送检较深层的组织进行活检始能得出正确诊断。在深部的组织内可见疏松的黏液基质,其中散在横纹肌母细胞,很难找到胞浆内横纹。电镜下胞浆内可见粗的或细的微丝。免疫组化染色:Desmin和Myoglobin可以呈阳性反应。肿瘤内常可见被包围的小胆管增生,周围可见密集的肿瘤细胞。
【临床表现及诊断】
肝胆横纹肌肉瘤罕见,发病年龄较恶性间叶瘤小,可发生于从16个月的婴儿至11岁儿童,平均年龄2~4岁。
临床主要表现为发烧、乏力、腹胀、肝大、腹部包块、腹痛、发热、纳差、腹泻。常产生阻塞性黄疸,可为间歇性黄疸,但后期为持续性、梗阻性。并有肝内转移,然后转移至腹膜后或肺。北京儿童医院报道1962~1997年共收治横纹肌肉瘤155例,其中4例为小儿胆道的横纹肌肉瘤,年龄为1-4岁。均以黄疸进行性加重而就诊,伴肝大,陶土样大便。
实验室检查可见碱性磷酸酶、5-核苷酸酶和胆红素升高。超声和CT显示肝外胆管肿瘤,可以证实肿瘤发生部位。肝门区胆管常有不同程度和范围的扩张,内含稍低密度的肿块影,CT值25~35HU。近端胆管呈梗阻性增宽。超声于肝门区见息肉样中等回声块影,周围有胆汁围绕,构成完全或不完全性环形的液性暗区,无尾随之声曳,具一定特征性。当肿瘤向胆管周围侵犯时,则仅见包绕胆总管的肝门区附近低密度不均匀瘤块,肿物密度较低与含有粘液性基质有关。偶见囊性变,一般无包膜。肿瘤可不均等轻度增强。超声示肝内实性不均匀回声。影像学所见缺少特性。
术前PTC或术中胆管造影,能直接显示胆管内息肉样肿物所致的充盈缺损和胆管梗阻程度和部位。
【治疗和预后】
一期性的根治性手术切除是治疗横纹肌肉瘤的最快、最确实的方法。肝胆横纹肌肉瘤如果可能应力争行根治性手术切除,术后用化疗和放疗,有些病人得到长期缓解甚至治愈。但许多病例至就诊时已经出现明显的浸润或转移导致手术切除困难。
文献报道多数病人预后较差,相当多的病例在6个月~一年内死亡。近年有学者报道对于浸润的病例手术前进行多疗程大剂量的化疗后,可以提高手术切除率和生存率。化疗药物可联合应用长春新碱、放线菌素D及环磷酰胺, 或应用顺铂、异环磷酰胺等联合化疗药物。
第五节 肝恶性间叶瘤及未分化肉瘤
肝的恶性间叶瘤(malignant mesenchymal tumor)是一种具有高度侵袭性的恶性肿瘤,这种肿瘤非常罕见。也有被称为未分化胚胎性肉瘤(undifferentiated embryonal sarcoma,UES)或未分化间叶肉瘤(undifferentiated mesenchymal sarcoma)。大部分病例发生于小儿,诊断年龄多在6~10岁,仅有少数发生于婴幼儿和成人。男女发病数相近。
【病理表现】
肿瘤肉眼所见为肝内圆形肿块,极少见有蒂与肝脏相连,肿瘤周围有假包膜与正常肝组织分界。多生长较大。剖面肿瘤呈胶冻样,常见出血、坏死和囊肿形成。镜下肿瘤由小细胞构成,有圆形核和不明显的核仁,含少量界限不十分清楚的胞浆。有些则为小梭形细胞和星形细胞,成片或散在于黏液基质内,形成密集区和疏松区交替排列的现象。有时瘤细胞浆呈空泡状,苏丹染色呈阳性反应。电镜下这种细胞很像脂肪母细胞。此外,还可见到成簇或散在的多核巨细胞及间变型大细胞,核形怪异,染色质丰富,染色深,不典型核分裂常见,胞浆丰富粉染,有些胞浆内和间质区可见嗜酸性透明小体,PAS染色阳性。抗淀粉酶消化。这些细胞常见于坏死灶周围,使肿瘤形态很像多形性横纹肌肉瘤,但胞浆内找不到横纹,Myoglobin和Desmin染色呈阴性反应。肿瘤边缘和假包膜内常见腺管结构,腺管上皮常见不典型增生,估计是被肿瘤包围的胆小管。电镜检查:巨细胞内可见有膜包绕的高度嗜锇酸颗粒,肿瘤内还可见到成束紧密交织排列的梭形细胞,很像纤维肉瘤或纤维组织细胞瘤。免疫组化染色:Vimentin和α-1Anti-trypsin呈阳性反应,Cytokeratin,Myoglobin和Desmin呈阴性反应。见图9。
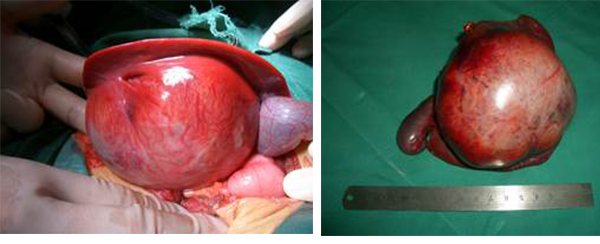
图9:示肝脏肉瘤的手术大体标本所见,男,4岁

图10:示肝中叶肝脏肉瘤CT所见
【临床表现】
为儿童期少见肿瘤,占小儿原发性肝肿瘤的第四位。发病年龄大多6~10岁,亦可见于成人及幼童。临床主要表现为上腹部肿物,伴有发烧、黄疸和体重下降。肿瘤发生于肝内,右叶比左叶多见。该肿瘤生长迅速,恶性度高,晚期转移至肺及骨骼,存活期多为一年左右,预后不良。
【诊断】
实验室检查除个别病例偶见SGOT和碱性磷酸酶异常外,没有其他异常发现,AFP试验多为阴性。血管造影肿瘤常表现血管少,因此有些病例和肝脓肿混淆。超声检查可见囊性和实性病变。
CT提示巨块肿瘤可侵占一或两叶肝。肿瘤呈椭圆形或大分叶状低密度肿块。CT所见取决于大体病理。可为分隔多房的囊性肿物,囊腔大小不一呈水样密度,粗细不匀的分隔为肿瘤的实性部分,密度与肌肉相仿,CT值约35HU。周围有假性包膜。有时肿瘤呈单一大囊腔,内含无定形絮团状阴影,部分呈蜗轮状,内壁见高密度息肉阴影附着示肿瘤内出血。肿瘤亦可以实性为主,内含多数小囊。肿瘤血供多少不定,囊性病变明显的病例,血供一般较少或无血供。增强扫描,实性部分及包膜可有强化,囊性部分增强不明显,CT值在22~28HU,偶见钙化。本病需结合临床、影像学所见与间叶错构瘤鉴别。
【治疗】
恶性间叶瘤预后很差,在能手术切除的病例,术后需要采用化疗,如长春新碱和Doxorubicin;不能手术的病例只能用化疗和放疗,除上述化疗药物外,采用Cispatin和Doxorubicin搭配放疗,文献曾有一例患者经此治疗后肿瘤消失。
预后:多数病人在术后12~16个月后复发,平均生存时间为12个月。肿瘤局部复发和邻近器官扩散及远处器官转移一样多见。
第六节 肝脏板层癌
肝脏板层癌(fibrolemellar carcinoma of the liver)也被称为伴有纤维间质的肝多边形细胞癌(polygonal cell carcinoma of the liver),是一种变异的肝细胞癌,或称为肝细胞癌的一种组织学亚型,发生在年龄较大的儿童和青年人。该瘤多发生在没有肝硬化的病人,预后较肝细胞癌好。
【病理】
肿瘤发生部位在左叶较右叶多见,常为孤立性存在的肿块,只有少数的为多发性结节状病灶。肉眼所见的和肝的局灶性结节状增生(FNH)相似。镜下表现:肿瘤细胞体积大,多边形,含丰富的嗜伊红染色的胞浆,部分病例的胞浆内可见苍白淡染的胞浆和嗜酸性透明小体,PSA染色阴性。核和肝细胞癌的核相似,具有很突出的核仁,但核分裂像很少见。免疫组化染色,肿瘤细胞浆内含纤维蛋白原,甲胎蛋白染色阴性,个别病例α-1抗胰蛋白酶阳性。电镜检查,肿瘤细胞浆内可见大量线粒体,与腮腺肿瘤和甲状腺肿瘤胞浆内的改变相似。肿瘤间质含大量纤维组织,有些纤维束平行排列,形态和肝的局灶性结节状增生相似。有些学者认为此瘤和局灶性结节状增生关系密切。

图11:示肝脏板层癌的手术大体标本所见,女,6岁
【临床表现】
临床多表现腹部肿物伴有腹痛或上腹部胀。部分伴有发热、体重下降和食欲不振等。肿块多生长缓慢,恶病质出现较晚。
【治疗】
和肝细胞癌一样,有效的治疗是完整切除肿瘤,即肿瘤肝叶的根治性切除。该症较肝细胞癌预后要好。一组报道12例,2年和5年的生存率分别为82%和62%。手术后同样需要应用化疗,常用药物有表阿霉素、5-FU、VP-16和顺铂等。
第七节 肝脏转移性肿瘤
由于小儿恶性肿瘤多为胚胎性,具有分化低转移早的特点。而肝脏是人体最大的腺体器官,血供丰富,因此肝脏转移性肿瘤很常见。实际上除了中枢神经系统外,其它实性肿瘤均可转移至肝。临床上最多见于腹部原发瘤的转移,其中以神经母细胞瘤、肾母细胞瘤、恶性淋巴瘤、横纹肌肉瘤等较多见。一组小儿恶性肿瘤的尸检报告,45%有肝脏转移。
【病因、病理】
肝脏是各种恶性肿瘤易发生转移的脏器,为转移癌的好发部位之一。许多部位和脏器的恶性肿瘤都会经血行或淋巴途径转移至肝脏。由于肝脏门静脉引流的特点,消化道及腹部其他恶性肿瘤出现远处转移,最常见的部位即为肝脏。在小儿时期常见的肝转移肿瘤多来自消化道、肺、胰腺、肾等部位。
转移瘤的大小、数目和形态多变,以多个结节灶较普遍,也有形成巨块的。其组织学特征与原发肿瘤相似。转移灶可发生坏死、囊性变、病灶内出血以及钙化等。
肝恶性淋巴瘤及白血病常被认为是转移,近年多数学者倾向于认为很可能系多中心起源,即肝内的肿瘤是恶性淋巴瘤或白血病全身性病变的一部分。
【临床表现】
转移性肝脏恶性肿瘤常以肝外原发性肿瘤所引起的症状为主要表现。早期无特异症状,有乏力、消瘦、肝区痛、继而为肝大、黄疸、腹水、发热等。但也有部分病儿在出现了如消瘦、乏力、肝区疼痛、肝区结节性肿块,甚至腹水、黄疽等继发性肝癌的症状以后,其原发癌灶仍不易被查出。因此,有时与原发性肝脏恶性肿瘤难以鉴别。
若病变已转移到肝,说明原发癌肿已属晚期,一般多已不能手术切除,预后较差。
【诊断及特殊检查】
临床表现和实验室资料是证实肝转移和明确转移程度的重要指标。
1、CT检查 表现多种形态,通常为单或多发的低密度灶,CT值15~45HU,以多个结节最常见。分布于肝的外围部为主。增强时轮廓更鲜明。等密度的转移瘤增强前后对比观察尤为重要。部分肿瘤由不同密度区为肿瘤坏死,周边常有环行增强。偶见薄壁囊样或较高密度的转移瘤。部分转移瘤影象学征象与原发瘤所见相同。见图12。

图12:示肝脏内恶性淋巴瘤转移的CT所见,男,6岁
2、MRI检查 用于评价肝内病变有助于鉴别良恶性肿瘤。在各种影象学检查中,MRI发现肝转移瘤最敏感。因此,MRI可作为一种重要的检查方法。多数转移瘤T1、T2延长,在T1加权像上为低信号,T2加权像上为高信号。转移瘤的形态不规则,边缘不清,大小不等。由于瘤体内可出现坏死、囊变、出血、脂肪浸润、萎缩、纤维化、钙化等改变,MRI信号可不均匀呈混杂信号。此外,在T2加权象上肝转移瘤可出现“靶征”或“牛眼征”,表现为信号高低不一的晕环。
不同恶性肿瘤的肝内转移,其影像学改变也不尽相同。神经母细胞瘤转移灶可呈多种形态:①散在低密度结节含钙化;②多个结节互相融合,呈一个巨块型分叶状密度不均等的肿块,类似肝内原发瘤。此时需十分注意肾上腺区有无肿块或腹膜后淋巴结转移;③肝脏普遍性增大,密度稍减而不均匀,示细小结节分布;④正常肝形态。
肾母细胞瘤转移可为单或多发散在低密度结节,可有轻度增强。
淋巴瘤和白血病多数表现为不同程度的肝、脾肿大。少数则于肝和/或脾内散在小圆形或不规则的密度灶,增强不明显。腹腔内和/或腹膜后多数结节状淋巴结肿大为重要佐证。
【治疗】
1、手术治疗 如肝仅为孤立的转移性癌结节或癌结节仅局限于一叶,而原发灶又可以切除时,则肝继发性瘤可与原发瘤同期或二期手术切除。如原发性癌已切除一定时期后才出现肝内转移癌,局部病灶符合切除条件,又无其他部位转移表现者,也适宜手术切除。随着手术技术的进步,麻醉技术及麻醉药品的发展使得肝转移瘤的手术更加安全,适应症更为广泛。
2、全身化疗 在临床应用较为广泛,目前临床上常选用蒽环类、丝裂霉素、顺铂、卡铂和5-氟脲嘧啶及其衍生物等作为化疗药。但是,化疗效果不太令人满意。神经内分泌肿瘤常转移至肝脏,可采用化学治疗。文献报道类癌肝转移瘤的化疗有效率仅占30%左右。
3、肝动脉灌注化疗 众所周知,肝脏存在双重供血即肝动脉和门静脉供血。正常肝组织主要由门静脉供血,约占85-90%;而肝转移瘤的血供主要来源于肝动脉,约占90-95%。目前,对于肝转移瘤特别是多发性肝内转移瘤,已广泛采用肝动脉灌注化疗。主要操作方法是,经股动脉穿刺,将造影导管超选择性插入肝固有动脉或肝内转移瘤相应的供血动脉。先行肝动脉造影,进一步明确诊断和血供情况。经导管直接肝动脉内灌注化疗药物。根据原发肿瘤的来源不同调整化疗方案。常选用的化疗药物与全身化疗用药相似。一般采用三药联合给药。肝动脉灌注化疗的使用范围较广泛,除少数碘过敏病人外,无特殊禁忌症。肝动脉灌注化疗后的常见症状与全身化疗相同,主要表现为药物性肝炎,转氨酶升高,血清胆红素上升。恶心、呕吐、厌食,粘膜炎症,骨髓抑制等等。
4、肝动脉结扎或栓塞治疗 由于肝转移瘤的血供主要来自肝动脉,而正常肝组织的血供主要来自门静脉, 因此,阻断肝动脉血流对正常肝组织的功能影响较小,而能够最大限度地使得肿瘤组织缺血坏死或缩小。由于单纯结扎肝动脉后侧枝循环建立较快,所以治疗效果短暂。目前外科手术肝动脉结扎术已被经皮经导管肝动脉内栓塞治疗所代替。常用的栓塞材料有普通碘化油、乳化碘油、聚乙烯醇微球、明胶海绵颗粒、血凝块、中药白芨、玻璃微球等等。以上材料可以通过介入放射学方法导入肝动脉内。其中乳化碘油作为末梢血管栓塞剂应用最为广泛。乳化碘油进入肝动脉后存留在肿瘤的毛细血管网中,使肿瘤组织失去血液供应。且不易形成侧枝循环。尽管如此,栓塞治疗仅实用于血供较丰富的转移瘤,如神经内分泌肿瘤肝转移。有研究表明,单纯肝动脉栓塞,对少血供的肝转移瘤疗效较差。另一组22例胰岛细胞癌肝转移采用聚乙烯醇微球(PVA)或明胶海绵微球(Gelfoam)栓塞治疗,其中位生存期为33个月。
尽管栓塞治疗一般安全可靠,但亦可能发生并发症。如:胆囊炎、肝脓肿、类癌危象、肾功能不全、肠梗阻、恶心、呕吐、发热、疼痛和肝功能变化。较罕见的并发症有肝坏死、急性胆囊炎、小肠缺血性坏死、胰腺梗塞和胰腺炎、肺梗塞引起的呼吸困难。此外,由于细胞快速坏死溶解出现肿瘤分解综合症,高尿酸血症引起肾功能损害。治疗前肝功能检查和了解肿瘤的状态是十分必要的。
第八节 肝脏错构瘤
肝错构瘤(hepatic hamartoma)是一种少见的胚胎和胎肝发育异常的肝脏良性肿瘤,多见于婴幼儿。发病率大约占原发性肝肿瘤的6%。男孩发病率稍高于女孩。多见于两岁以内的婴幼儿。有一组文献中报道的发病年龄自新生儿至10岁,平均年龄为10个月。
【病因】
肝脏错构瘤的发生机制尚未完全明了,不同的学者曾提出不同的机理,归纳如下。①肝内胆管畸形引起胆道梗阻,近端胆管扩张;②血管内膜纤维化引起血液循环障碍,间质内液体贮积;③胆管畸形加上血管阻塞。目前比较倾向于第三种观点。认为由于胆管畸形引起小胆管囊样扩张,加之血管内膜纤维化引起血液循环的障碍,使得肿瘤内液体贮留,造成肿瘤发生。但确切的发病机理有待进一步深入研究。
【病理学改变】
是一种先天性疾病。1904年,Albercht首先使用“错构瘤”这一名词,描述由正常组织异常堆积所构成的瘤样畸形,通常为孤立的病变,而肝脏的错构瘤偶可为多发性肿块。
1、大体形态 肿块可发生于肝脏任何部位,以右叶最多见。多为单发,偶为多发。肿块带蒂或突出于肝表面。病灶一般为球形或卵圆形,表面常高低不平,可有包膜,有时与周围正常肝组织分界不清,或有卫星病灶。切面多为囊实性,少数为实性。囊腔小至肉眼几乎不能分辨,大到直径15cm。囊液澄清、黄色或胶冻状。实性部分为白色或黄褐色质韧组织。
2、分类及组织学特点 根据肝错构瘤的组织来源不同,分为内胚层性、中胚层性、内中外胚层性及混合性错构瘤四大类。中胚层性错构瘤主要来自中胚层细胞,又可分为间叶性和血管性两种。间叶性错构瘤为最常见类型。血管性错构瘤以血管和纤维结缔组织增生为主,肝细胞和胆管占的比例少,有学者将其归为海绵状血管瘤,不把它看作错构瘤。内中外三胚层性错构瘤由肝细胞,胆管 、血管和淋巴管上皮细胞,神经胶质细胞组成。内胚层性错构瘤主要来自内胚层细胞,又可分为实质性和胆管性两种。胆管性错构瘤以胆管及其上皮细胞和胶原纤维增生为主。实质性者(亦称为上皮性错构瘤)以肝细胞为主,含少量胆管、淋巴细胞。 以下重点介绍两种最常见的病理类型。
(1)间叶错构瘤(mesenchymal hamartoma)
主要由分化成熟但排列紊乱的间叶组织、胆管、淋巴管和肝细胞组成,其中间叶成分由呈疏松的粘液样间质中的星形细胞和胶原的混合物组成,常发生囊性变,大部分肿瘤体积较大,有些和儿头等大,婴儿常负有超过1000g的肝脏肿瘤。呈分叶状,多数肿瘤内可见囊肿形成。剖面肿瘤含胶冻样间质,其中散在大小不等的囊肿,囊腔内含浆液或粘稠液。多无出血、坏死和钙化。
镜下检查:其间可见扩张的胆管、淋巴管及炎细胞浸润,肝细胞单个散在或成簇排列,肝小叶结构消失。该瘤在富有粘多糖的基质中有散在分布的未成熟的中胚叶组织细胞,整个肿瘤有丰富的血运。胆管分布于中胚叶中,宛如正常的肝组织。肿瘤若发生在新生儿或年龄较小的病人,形态上有很多不规则的螺旋形小管,不规则地分布在含中等细胞量的粘液间质内。年龄较大的患儿,可见小管结构或囊肿形成,管壁或囊壁内衬立方上皮,形态和胆管上皮相似。有些囊肿内间质膨出形成乳头状结构。大的囊肿常看不到上皮结构。由于囊肿扩大和间质液潴留,使肿物迅速增大。肿瘤边缘可见交错存在的肝组织和肿瘤组织,两者没有明显的分界。有些病例肿瘤内含有大量毛细血管,血管内皮细胞增生肿胀,并可见髓外造血细胞。因此容易和血管内皮瘤混淆。但间叶错构瘤间质内的粘液液和扩张的淋巴管有助于和血管内皮瘤鉴别。见图13。
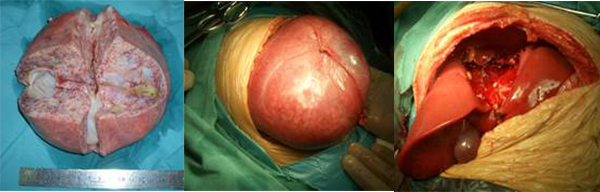
图26-13 示主要位于肝中叶的巨大肝脏错构瘤,手术所见,男,1岁。
(1):位于肝中叶的巨大肝脏错构瘤。(2)巨大肝脏错构瘤切除后手术标本。(3)肿瘤切除后肝脏左右叶保留,可以再修复肝脏外形。
(2)混合型肝错构瘤
混合性错构瘤(mixed hamartoma of the liver)是除肝内成分外还含有其他脏器或组织如肺、胃肠道的细胞或组织成分。相对少见,常表现多结节肿块,周围有纤维束分隔。混合型肝错构瘤与间叶性肝错构瘤不同,主要表现结节中心含胆管成分及被包围的肝索和肝小岛。成簇的小胆管很像婴儿胆管错构瘤或婴儿型多囊性疾患,但没有囊肿形成。
【临床表现】
绝大多数病例以腹围进行性增大或上腹部触及质硬肿块为主要临床特点,少数病例为尸体剖检时偶然发现。肿块可随呼吸上下移动,通常无压痛。本肿瘤约80%在一岁以内被发现,整个上腹部几乎均为巨大的肿物所占据。临床主要表现为腹部肿物,进行性增大。与肝母细胞瘤有很大的不同,后者常有营养障碍、消瘦、贫血等症,而本病即使随着患儿的生长而进行性增生,一般情况也往往较好。
【特殊检查及诊断】
手术前通过CT、MRI、B超等影像学检查可见肝脏内的占位性病变。多为实性,少数可见肿块内有囊肿。腹部平片常显示右上腹部有非钙化性肿块。肝扫描可见无功能区。肿瘤好发于肝的右叶(约占75%~80%),有些可见有很粗的蒂与肝相联。约15%~30%的肿瘤发生于肝前下叶,表面有蒂与肝相连,其余发生在肝的左叶。多发性病变可发生于肝的左右两叶。见图14。
肝功检查多正常。AFP在较大婴儿或幼儿多正常,可作为与肝母细胞瘤鉴别的一个重要参考。但在小婴儿有不少增高的报道,考虑可能与新生儿或小婴儿正常生理状况AFP即处于高水平有关。

图14:示肝脏巨大错构瘤的CT所见 男7个月
【治疗及预后】
目前尚未发现错构瘤发生恶变,手术切除是治疗本病的最好方法,可行肿瘤摘除或肝叶切除术,预后良好。
笔者曾经历一例,新生儿期因右上腹部巨大肿块而入院,CT示肝右叶实性肿瘤,并挤压肝门,考虑手术困难,同时患儿合并较严重呼吸道感染,家长顾虑而自动出院,但3个月后患儿生长发育良好,而再次入院要求手术治疗,再次CT检查,发现正常肝脏组织反而生长快于肿瘤,根据CT判断手术切除要较新生儿期为易。最终本例成功接受肝右叶切除,预后良好。一般认为本病虽为良性,但可生长至很大,给手术增加难度,另外手术前常难以与肝母细胞瘤进行区分,发现后宜尽早手术。
对肿块较大无法切除者,有报道给予放射治疗或环磷酰胺等化疗有一定疗效,但不确实。
第九节 肝脏血管瘤
肝脏血管瘤(hemangioma of the liver) 在肝脏的良性肿瘤中肝血管瘤最为常见。自B超声诊断普遍应用于临床以后,在成人肝血管瘤是门诊病人中最常遇到的肝内占位性病变,在小儿病例临床发现也较前增加。
肝脏海绵状血管瘤的确切发病率尚难于估计,过去多是腹部手术时偶然或在尸检时发现,现在则多可通过现代诊断技术发现。
【病因】
对于血管瘤形成的原因认识尚不统一。多数认为肝血管瘤起源于肝脏胚胎血管错构芽,在一定条件下胚胎血管错构芽发生瘤样增生. 形成血管瘤。而对于成人病例,有学者认为来源于肝内血管结构发育异常,而随后血管瘤的增大或由于血窦内血液淤滞和压力,使血窦扩张而不是真正的新生物;也有认为是肝实质坏死、出血、血管扩张而形成。
有少数病人手术切除血管瘤许多年之后又复发并呈现典型的海绵状血管瘤结构,故亦有认为此类肿瘤也可能是真正的新生物。肝海绵状血管瘤的发生可能与雌激素有关,有关于服用口服避孕药有促使其发生或复发的报道。
【病理改变】
小儿的肝脏血管瘤主要包括婴幼儿血管内皮瘤(infantile hemangioendothelioma)和海绵状血管瘤(cavernus hemangioma)两种良性血管瘤。肝的血管内皮细胞瘤多在生后6个月以内被发现,但有症状的海绵状血管瘤则多在生后2个月内被发现。
1、婴儿型血管内皮瘤
肉眼观,肿瘤由单或多个圆形分离结节构成。一般表现为肝内孤立性肿物,也可见多发性病灶,发生于肝的一叶或两叶。病理表现:肿瘤直径约0.2~15cm,剖面灰白色或紫红色,与周围肝组织分界不十分清楚,中心部分有时可见灰黄色斑点状钙化。根据组织学表现又可分成两型。
(1)Ⅰ型婴儿型血管内皮瘤:是最常见的类型,肿瘤组织由大小不等的血管构成,管腔内壁可见肿胀增生的血管内皮细胞,核分裂像很少见。血管之间可见黏液纤维基质。有些区域细胞比较密集,其中可见小管、圆形血管或分枝状血管混杂存在,间质内和血管腔内可见小灶状髓外造血细胞。有些肿瘤中心部分可看到血栓形成,钙盐沉积和进行性纤维化。这种改变是一种自发性消退的表现,由于肿瘤内可看到黏液纤维基质,小胆管和血管,需要和间叶错构瘤鉴别。间叶错构瘤没有那么多增生的血管,而且除血管外还可见到淋巴管。有报道,Ⅰ型血管内皮瘤经过数年后发展成血管肉瘤的病例。多取材,仔细查找有无血管肉瘤成分及随访病人很重要。
(2)Ⅱ型婴儿型血管内皮瘤:主要表现血管内皮细胞明显增生,不形成管腔,或管腔结构不清楚。有些区域可见血管腔互相吻合,管腔内皮细胞呈乳头状增生,内皮细胞有轻度异形,核分裂像很多见。Ⅱ型血管内皮瘤形态表现和血管肉瘤很相似,但血管肉瘤核分裂像很多见,并且可以看到肿瘤侵犯肝窦,沿肝窦生长。有些病例Ⅰ型和Ⅱ型血管内皮瘤混杂存在。见图15。

图15:示肝脏血管内皮瘤的手术所见 女4个月。
(1)位于肝脏右叶的血管内皮瘤,(2)采用局部切除的方法切除肿瘤,(3)切除的手术标本。
2、海绵状血管瘤
单或多发肿瘤分界清楚,偶尔有蒂。海绵状血管瘤在肝脏表面表现为暗红、蓝紫色呈囊样隆起、分叶或结节状,柔软,可压缩,但松开压力之后,又恢复至原形。切面为海绵状。由扩张的血管构成。和血管内皮瘤不同,其镜下主要由多数扩大的血管腔隙构成,有扁平的血管内皮细胞和薄的血管壁。血管腔内有时可见血栓形成。血管之间含不等量的纤维间质,没有恶性的潜能。前者腔隙内可见血管内皮细胞被复;后者血肿间隙没有内皮细胞覆盖。肝紫癜病在肉眼检查乃至镜下观察都与海绵状血管瘤极其相似,但肝紫癜病虽可见大量红细胞充满腔隙,但腔面没有血管内皮细胞被覆。肝海绵状血管瘤良性,尚无关于此肿瘤恶性变的记载
尸检时发现的肝海绵状血管瘤绝大多数是体积〈2cm的小肿瘤,而小的肝血管瘤在临床上只是个鉴别诊断的问题,往往缺乏更多的治疗意义。
【临床表现】
小的病变多无症状,经体检超声发现,较大的病变可造成上腹不适或触及包块。巨大血管瘤可使肝脏显著增大。本病多见于女性病人,男女性间的比例报道有不同,可从1∶1.5至1∶5。
婴儿型血管内皮瘤90%发生在6个月以下婴儿,表现为肝大,腹胀或包块。近20%伴皮肤血管瘤,也可伴有其它脏器血管瘤。少部分病例会同时发生在肝脏以外。如皮肤、肠管等。部分患儿出现心衰表现。心力衰竭往往是由于巨大的肿瘤内存在动静脉瘘,致短期内回心血量明显增加所致。另外少部分巨大的血管瘤可出现血管瘤血小板减少综合征的严重并发症。如果没有发现体表的血管瘤而患儿有血小板减少、出血、凝血机制不佳时应该考虑到血管瘤血小板减少综合征(Kasabach-Merritt Syndrom)的可能。其可能的机制为巨大的血管瘤内常滞留并消耗大量血小板、凝血因子和纤维蛋白原使凝血机制异常,出现贫血和血小板减少。小儿血管内皮瘤较海绵状血管瘤多见,多为多发性,较少形成巨大肿块。有潜在恶性。AFP可升高。
肝海绵状血管瘤多发现于青、中年病人,小儿较成人少见。小血管瘤无症状,较大者可于婴儿期出现无症状性腹部肿块或高心排出量引起的心功能衰竭。另外有相当多的病例在新生儿时期因肿瘤破溃导致腹腔内大出血而突然死亡。这种情况需要和新生儿产伤所致肝内血肿破裂鉴别。部分病例也可出现血管瘤血小板减少综合征。而年长儿或在青、中年病人因多属于体检是发现,很难确定其准确的发病时间,虽然常是偶然发现,但追溯起来也有一定症状,只是较轻和进展较缓慢,未曾引起病人的足够注意。最常见的症状是上腹部不适、发胀、进食后膨胀感、易劳累、隐痛等,不很常见的症状是较重的疼痛、呈持续性,发热、贫血。有的病人因发生血管瘤出血,可出现急剧的涨痛、上腹部出现肿块并呈增大。有报道一例11岁儿童病人因轻度外伤后出现右上腹迅速增大的肿块,手术证实为肝包膜下血肿,在血肿的底部有一直径约1.5cm的血管瘤。
位于肝左叶、肝右叶下段的海绵状血管瘤,查体时多表现为上腹部肿块,柔软至中等硬度,表面光滑,有可压缩性,随呼吸上、下移动,一般无触痛或血管性杂音。位于肝右叶上段的海绵状血管瘤往往是在瘤体增大时将肝脏向下移位,检查时可发现右肋下肿大肝脏的边缘,若没有现代影象诊断技术,诊断很困难。
【诊断】
肝血管瘤的诊断主要依靠现代影象诊断的发现。虽然如此,直径在2.0cm以内的小的血管瘤,鉴别诊断上有时仍然很困难。
1、超声表现:
超声检查往往是首选的和最常见的影象诊断,显示肝内均质、强回声病变,边界大多清楚,或病变区内强回声伴不规则低回声,病变内可显示扩张的血窦。小的血管瘤应注意与转移瘤区别。
2、CT表现:
(1)平扫:肝内低密度区,轮廓清楚,密度均匀或病变区内有更低密度区,代表血栓机化或纤维分隔,少数可见到钙化。
(2)增强扫描:①早期病变边缘显著强化呈结节状或“岛屿状”,密度与邻近腹主动脉相近,明显高于周围肝实质密度,持续时间加长。②随着时间延长,增强幅度向病变中央推近,而病变的低密度区相对变小。③延时扫描病变呈等密度或略高密度(平扫时病变内更低密度无变化)。增强扫描是诊断肝海绵状血管瘤的重要方法,具有特征性表现,诊断正确率可在90%以上。一般典型表现出现在动脉早期,即注药后30~60秒。因此强调正确的检查技术,即快速注射造影剂,快速扫描,适时延时扫描。否则,因未见到特征性表现易造成误诊或漏诊。
婴儿血管内皮细胞瘤的增强扫描,早期肿瘤周边部密度增高,伴整个病灶不规则增强,随着周边部密度下降,中心部逐渐强化,延迟扫描,肿瘤逐渐呈等密度灶。中心无增强区代表坏死或出血。海绵状血管瘤增强扫描早期肿瘤边缘部见致密结节状、波浪状或向瘤内隆起的乳头状阴影。动态和延迟扫描所见同婴儿血管内皮细胞瘤。此种特殊的增强过程为血管瘤的特征性表现,具定性诊断意义。但较小的肿瘤迅速整个强化(高密度似主动脉),不显示向心性强化过程。
3、同位素99mTC肝血池扫描
有助于肝血管瘤的诊断,血池扫描显示病变部分充盈缺损,边缘清楚锐利,有明显的的放射浓集区,血管瘤显影时间较长。
4、MRI检查
MRI的表现具有特异性。在T1加权图像上多呈均匀的低信号或等信号强度,T2加权图像上呈均匀的高信号,弛豫时间延长,并随回波时间延长信号强度增强,边界清楚。
5、肝血管造影检查
肝血管造影最有价值,具有特征性。可见营养血管的肝动脉扩张,肿瘤内分布的动脉呈弧状,末梢的造影剂渗入,动脉相早期可见树枝状的静脉样形态的异常血管出现,毛细血管相可见内部不均一,地图状的造影剂滞留像。但本法是创伤性检查,对于小儿常需全身麻醉,实际临床应用是受到较大的限制。
【鉴别诊断】
海绵状血管瘤主要与肝内恶性肿瘤的鉴别。
1.肝细胞癌:一般有肝炎、肝硬变病史,一般情况较差。AFP可为阳性,静脉增强扫描有助鉴别。
2.肝转移瘤:部分肝内转移瘤增强扫描可表现边缘强化,类似血管瘤早期表现,但延时扫描呈低密度可资鉴别。往往合并全身一般情况差,甚至恶病质的表现,可发现原发病变。
3.肝脓肿:一般病变周围界限不清、模糊,脓肿周围可见低密度晕环,典型的病变周围强化,病变内气体存在。需结合临床表现。
【治疗】
小儿肝血管瘤与其他血管瘤一样,存在自行消退的可能性,因此在治疗原则的确定时就需要特别慎重。是采取期待、观察的方法还是积极地进行外科干预,不同的学者之间也存在较大的争论。肝血管瘤切除手术在缺乏必要的设备和技术条件下,手术有一定的危险性和并发症,因而必须根据每个患儿的具体情况、肿瘤的大小和位置、有无明显的临床症状等,做出手术或非手术治疗的决策。综合国内外多数学者的经验和治疗主张可以归纳为如下的治疗原则。
1、无任何临床症状,肿瘤较小病例的治疗 可以采用观察,定期复查的方法以期望血管
瘤自行消退。
2、肝脏血管瘤合并Kasabach-Merritt综合征的治疗 可采用激素疗法。先使用大剂量地塞米松静脉注射,后改为强地松口服,对血小板减少往往有效,并可使肿瘤明显缩小。对部分严重的病例有应用放射治疗取得满意效果的报道。
3、肝脏血管瘤合并心力衰竭时的治疗。发生心力衰竭的主要原因是血管瘤内存在多量的动静脉交通短路,大量血液不经过周围小血管直接经过短路回流入心,引起心脏负担过重。治疗时应根据发病机理,一方面给予强心药物,另一方面更重要的是阻断短路交通。可进行选择性肝动脉造影及肿瘤动脉栓塞。肿瘤往往巨大,不能完全手术切除,有报道采用肝固有动脉结扎的方法,手术后取得立竿见影的效果。但也有手术后复发的可能。
4、肿瘤较大,有部分症状的治疗 对较大的肝海绵状血管瘤,若情况合适时,可以考虑手术切除,随着小儿肝胆外科技术水平的提高,现在一般手术死亡率和并发症率都有较大程度的降低。但巨大的或超大型的海绵状血管瘤多伴有较显著的临床症状,其手术切除亦较复杂,手术并发症率较高。巨大型肝海绵状血管瘤常与肝脏内、外的重要血管间有复杂的关系,如将下腔静脉包绕、压迫,包围第二肝门和主要肝静脉、下腔静脉移位、膈肌或腹膜粘连等,术前应该对肿瘤与各重要结构间的关系详细了解,权衡手术的利弊。
另外,肝海绵状血管瘤的非手术治疗方法有:①放射治疗;②选择性肝动脉造影及肿瘤动脉栓塞。此两种治疗措施有一定效果,可使肿瘤体积部分缩小,也有治愈的报道。近年来由于血管造影技术的显著进步,有条件的医院可以应用血管造影介入治疗技术进行血管栓塞治疗。
第十节 肝脏腺瘤
肝脏腺瘤(hepatocelluler adonoma)是一种临床上少见、来源于肝细胞的良性肿瘤,可发生与任何年龄。文献中最小一例为3周的新生儿,尸检时偶然发现。女性较男性多见。临床主要表现肝大,肿瘤可出现出血性梗塞,约1/4患儿可因肿瘤破裂继发腹腔内出血。肿瘤呈球形,常为单发,多局限于肝右叶。
【病因】
本病确切发病机制尚不清楚。有先天性和后天性两类,先天性肝腺瘤可能发育异常有关,多见于婴幼儿病例。后天可能与肝硬化后肝细胞结节状增生有关。报道认为与口服避孕药有密切关系。小儿肝腺瘤常常和其他疾病伴同发生,如Ⅰ型肝糖原累积症,病人常在10岁左右时发现肝腺瘤,用饮食治疗肝糖原累积症,腺瘤可以消失。雄性激素治疗Fanconi贫血,β-地中海性贫血有过量铁摄入的患者,或者合成类固醇治疗的患者等,都发现患儿有肝腺瘤发生,两者的关系不十分清楚。
【病理变化】
病理表现:肿瘤可发生在肝脏的深部或在肝的表面,很少见有蒂。为实质性肿块。肝腺瘤常有不完整包膜,边界清楚,隆起于肝表面,表面有丰富的血管,质软,切面呈淡黄色,有时有暗红或棕红色出血区。最常见的是孤立的结节,结节周围常可看到多数卫星结节。剖面表现为界限清楚的结节,呈均匀的黄褐色,偶见中心有坏死。真正的包膜不常见。
镜下可见肿瘤由分化良好的肝细胞组成,由2~3层细胞排列成索状或片状。结节内没有小叶结构,没有纤维间隔,没有小胆管增生,也没有门脉结构。有时瘤细胞体积比肝细胞稍大或有轻度异形。由于细胞内糖原含量多,胞浆内较多糖原和脂滴,细胞浆内有空泡形成。很少见到核分裂。电子显微镜下可见到瘤细胞内细胞器缺乏。
【临床表现】
肝腺瘤在成人和小孩都很少见,可发生与任何年龄。文献中最小一例为3周的新生儿,解剖时偶然发现。女性较男性多见。可发生在肝左叶或右叶,以右叶为多见。
患儿一般情况好,肿瘤小时可无任何症状,由于肿瘤生长缓慢,往往发展至巨大时才引起家长的注意。笔者治疗的一例14岁女孩,瘤肝的重量达4.8千克,而肿瘤切除手术后体重为41千克,肿瘤重量竟占体重的12%。 因肝脏肿块较大,可表现为右上腹部肿块,可引起腹胀、轻微腹痛等症状。见图16。个别病例可因下腔静脉被压迫而出现双下肢的水肿。
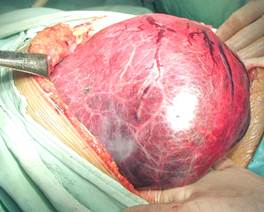
图16:示巨大肝脏腺瘤的手术中所见,女,14岁。瘤肝重4800克。
【诊断】
本病术前诊断较难,容易与肝母细胞瘤或肝癌相混淆。诊断主要依据影象学检查,尤以CT检查最具价值。
1.B超检查可见肝内孤立的圆形、椭圆形、边界清楚的低回声或中等回声肿块,肿瘤较大则回声杂乱、强弱不等。
2.CT平扫呈圆形稍低密度,与周围肝组织相差10Hu左右,病灶边界清楚,有包膜,其内可有更低密度的陈旧性出血、坏死灶。增强扫描早期可有短暂的均匀性增强,和正常肝组织对比十分明显,然后密度下降为等密度,延迟扫描为低密度。螺旋CT动脉期肿瘤密度高于正常肝组织,静脉期为等密度或低密度。见图17。

图17:示巨大肝脏腺瘤的CT所见,女,14岁。
3.MRI表现为肝内单发病灶,呈边界清楚的圆形肿物,T1 W1稍低信号、T2 W2稍高信号。也可T1 W1、T2 W1均为稍高信号或高信号,说明其内脂肪含量高或有出血,此信号改变具特征性,对病变的定性诊断有较大帮助。
4.放射性同位素Tc-吡哆醛5甲基色氨酸(Tc- PMT)及Ga-67扫描对肝腺瘤的诊断也有价值。Ga-67扫描表现为冷结节,Tc-PMT表现为早期的摄入、排泄延迟以及放射形稀疏。认为联合检测B超、CT、MRI和放射形核素检查可以提高本病的确诊率。同位素肝扫描显示肿瘤部位为同位素稀疏区。肝血管造影显示该区血管增多和明显的肿瘤边缘。
5.肝功等常规实验检查往往正常,血AFP正常是本病与小儿肝脏恶性肿瘤鉴别的一个重要的指标。
但临床实际中有时进行了上述的多种检查,手术前也无法获得准确的诊断。前述笔者经历的患儿曾转辗国内数家大医院,行B超、CT及MRI等检查,因高度怀疑肝母细胞瘤而行过肝血管造影并进行选择性肝动脉化疗性栓塞,因治疗无效而转至笔者处。术中见肿瘤巨大,表面有大量迂曲、隆起的血管,仍不能肯定诊断,最终手术切除后才获得病理诊断。见图18。
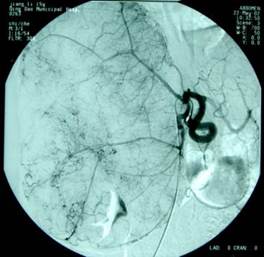
图18:示巨大肝脏腺瘤的DSA血管造影所见,女,14岁
【鉴别诊断】
需与肝母细胞瘤及肝细胞癌鉴别。CT检查中肝细胞腺瘤增强较为均匀,无结节中结节征象,也无被膜之环形增强征象。镜下肝腺瘤也需要和肝癌进行鉴别,尤其是肿瘤细胞有轻度异形者,常常很难和分化好的肝细胞癌鉴别。肝癌必须有细胞异形,出现较多的核分裂像,并有血管的浸润。这种病例应考虑为肝细胞癌。
【治疗】
切除是唯一的治疗方法,但操作难度大。由于本病有癌变倾向,并且有突然恶性变 的可能性,大多数学者主张对于诊断已明确或无法完全与肝母细胞瘤鉴别时尽早手术切除为最好的方法。手术包括肝叶段切除、 不规则肝切除、 包膜内肿瘤剜除术等多种方法,既可做到消除临床症状, 又可避免并发大出血及继发恶变。前述病例应用低温麻醉、开腹后探查见肿瘤位于肝右叶全部及部分尾状叶,采用先处理第一肝门的门静脉、右肝动脉、右肝管及胆囊管,再处理肝静脉、十余支肝短静脉后再切肝的办法顺利切除达4.8千克的巨大瘤肝。
第十一节 局灶性结节性肝脏增生
局灶性结节性肝脏增生(focal nodular hyperplasia)亦称局限性肝硬化、增生性结节或肝细胞胆管瘤等。本病常为良性,可发生于各年龄组,亦可在尸体解剖时偶然发现。目前多数认为是肿瘤,病变局限时应予以切除。
【病因病理】
小块活检标本或穿刺活检标本很难和结节性肝硬化或先天性纤维化鉴别。其病因尚不清楚。Edmondson认为,本病的发生机制似为局限性肝损害后的反应。Whelan认为,本病是动脉畸形造成动脉硬化的一种反应。病因不明,多见女性。
多认为肝局灶性结节增生为一种非常少见的良性占位性病变,实际上并非真正的肿瘤。仅占小儿原发性肝脏肿瘤或瘤样病变的2%左右。有些病例偶在尸检时被发现。诊断年龄多在5岁或5岁以上,极少数发生在新生儿并同时伴有先天性畸形。有报道本病可伴有以下几种疾患,如半身肥大、家族性胶质母细胞瘤或镰状细胞贫血等。
左叶发病较右叶稍多见,可以单发或多发,多发病变占总数的15%~20%。病理表现:本病的大体标本所见酷似恶性疾病。肿物多位于肝内,无包膜,表面呈细小或较粗大的结节,直径1~15cm,重量可达800克。表面有粗大的静脉,很像肝母细胞瘤。肿物为单发,位于包膜下或肝实质的深部,边界清楚,但常无包膜。切面呈灰色或灰褐色,中央有白色结缔组织,自中央向四周呈辐射状伸向间质,将肝组织分成许多小结节。剖面肿物呈结节状,结节中心可见星芒状或压迫性瘢痕,这种瘢痕多见于肿物的中心部分。组织学表现,结节内为形态正常的肝细胞,由2~3层细胞排列呈索或片状,但排列不整齐,无中心静脉,失去正常的肝小叶结构。胞浆内可见微小脂滴。结节周围可见宽的或细的纤维间隔。间隔内可见动脉和静脉,静脉管壁由于内膜和内膜下纤维组织增生而变厚,管腔狭窄。间隔内可见成簇的小胆管伴有不等量的中性粒细胞浸润,胆管周围尤其明显。肿物以外的肝组织没有明显的肝硬化。
【临床表现】
一般无症状。可表现为腹部肿块而感到上腹部不适,肿块多较硬。少数病例可自发性破裂而大出血。带蒂的结节发生扭转或破裂,可出现急性腹痛或继发腹腔内出血。曾有报道因多发性病灶而合并门脉高压者。
【特殊检查及诊断】
1.超声表现:可以有低、高或混合回声,缺乏特征性,可见纤维分隔。
2.CT表现:①平扫:肝内低密度或等密度改变,边界清楚。当中心存在纤维性疤痕时,可见从中心向边缘呈放射状分布之低密度影像为其特征。②增强:可为高密度、等密度或低密度不等,主要因其供血情况而不同。病变内纤维分隔无增强,动脉晚期病变呈低密度。
3.血管造影:典型病变可表现为血管呈放射状分布如轮辐样和外围血管的抱球现象。
4.同位素99mTc胶体硫扫描:65%的病变可见有核素浓聚,因该种病变内有肝巨噬细胞所以能凝聚核素,这点和其他良恶性肿瘤不同,因而有较高诊断价值。
5.MRI表现:表现为等T1、长T2信号,边缘清晰,内T1W及T2W压脂像上,上述改变更加清晰。

图19:示FNH患儿CT图像
【治疗】
目前尚无本病恶变的报道,经长期观察多数病人肿瘤无增大,有的甚至变小或原有症状消失,一般不破裂出血,因此对无症状者可以密切观察。而无须积极地进行手术治疗。对于诊断不明确、有临床症状或观察中发现肿瘤生长较快者,应行手术治疗。方式以局部切除及肝段切除为主,大的病变完全切除困难者可以结扎其供应血管,可不必涉险行大的肝叶或多叶肝脏切除。
第十二节 肝脏炎性假瘤
肝脏炎性假瘤(Inflammatory pseudotumor of the liver)是一种非常少见的肝脏良性病变。自Pack等(1953年)首次报告以来,特别是80年代以来随着现代影像诊断技术的发展和肝脏手术技术的极大进步,该病检出率逐渐增加而被国内外学者所认识。这类病变主要由纤维基质和以浆细胞为主的各种慢性炎性细胞所组成,基本的病理特征为炎性增生肿块。对于发生在某些器官的由各类慢性炎性细胞所构成的肿瘤样炎性肿块,以往不同作者对这类病变的描述和命名不一,诸如组织细胞瘤、浆细胞瘤、黄色肉芽肿、浆细胞肉芽肿、炎症后肿瘤、硬化性假瘤、纤维黄色瘤等 。80年代中期以来,人们开始使用炎性假瘤这一名称来概括这类病变。
【病因】
肝脏炎性假瘤的病因尚不明了,但作为一个以实体形式发生在某一肝段的炎性肿块,它标志着肝内一个活动的局限性炎症过程。有人认为可能与感染有关,因为这类病人发病初期有发烧、贫血、体重减轻等全身症状,但多数病例未在病变中找到细菌,所以有人指出可能是非细菌性感染所致的肝脏局限性损害。有报道一例经皮穿刺细胞学检查诊为恶性肿瘤而行手术切除,术后经组织学检查确定为炎性假瘤,镜检见到大量泡沫组织细胞和少数浆细胞和淋巴细胞,同时见到大量革兰氏阳性球菌,提示该病变系对肝内细菌感染的一种异常组织反应。有学者倾向于认为源自局部门静脉或胆道系统的感染。有一组报道的5例病例,4例在发病前有腹部手术或右胸部外伤史,提示手术或外伤诱发经门静脉或胆道系统的上行性感染可能与发病有关。
也有人提出,本病的发生可能与免疫反应有关,因为病变内见到大量浆细胞,考虑可能是机体受内源性或外源性的抗原或半抗原物质刺激后产生的免疫病理反应,而细菌、真菌、抗生素、磺胺类、碘、二硝基氯苯、阿司匹林、非那西丁、漆以及许多低分子化学物质等都可能成为抗原性刺激。机体的免疫反应除了识别和清除异物以维护机体的生理正常外,免疫反应也能引起机体生理功能的紊乱或造成组织的损伤从而引起某些病变。有的学者指出肝脏炎性假瘤可能属于这类变态反应。有人在肝脏炎性假瘤的血管中看到了静脉管壁的细胞增生、炎症和管腔闭塞的改变,并称之为闭塞性静脉炎。他们认为这些变化与Riedel甲状腺炎,特发性腹膜后纤维化和纵隔纤维化等血管改变是相同的,所以提出它是一种自身免疫性疾病。有的病变血管内也见到血管壁的细胞增生、管腔狭窄等改变,这些血管变化可能与感染或免疫反应有关或两者同时兼有。
【病理学改变】
临床或影象学上所谓的肝脏炎性假瘤,在病理上表现为圆形或椭圆形的肿瘤样肿块,有较为完整的包膜,界限清楚,坚硬具有张力,病变剖面是光滑平坦,多呈黄色;镜下主要是浆细胞、组织细胞、成纤维细胞、环状细胞等各种炎性细胞,病变周围组织有明显炎症或纤维反应,并伴有丰富的纤维组织出现,有的可见大量肝细胞坏死,但少有液化。
在病理形态上可分为黄色肉芽肿型,浆细胞性肉芽肿型和透明硬化型三种。三种形态可在同一病例中混合存在,而往往以一种类型为主。反映机体对不同病因或在不同病程阶段的不同反应。病变内细胞以分化成熟的炎性细胞为主,并可伴有不同程度的纤维母细胞、 静脉血管内皮细胞增生及纤维化。黄色肉芽肿型以组织细胞、黄色瘤细胞的增生为主。浆细胞性肉芽肿型以淋巴细胞、浆细胞浸润为主。而透明硬化型则以炎症背景下的纤维母细胞增生和胶原纤维玻璃样变性为主要特征。各型均无细胞异型性,反映了病变的炎症性质。
病灶周围肝组织无硬化的背景。浆细胞性肉芽肿型肝炎性假瘤在病理上需要与肝恶性淋巴瘤鉴别。后者以T细胞淋巴瘤多见,肝脏呈弥漫性肿大,常不形成局限性肿块。而炎性假瘤成分较复杂,分化成熟,核分裂相少见。免疫标记呈多克隆性淋巴细胞增生,血象和骨髓象也无恶性征象。肝脏通常无硬化,病变多局限,境界清楚,质地较硬,在肝的表面或略隆起触摸有实质性硬韧感。切开病变组织见其剖面光滑平坦切面呈黄色多有较完整包膜,有的病例可看到炎性假瘤与腹壁或膈肌、周围脏器有炎性粘连。上述改变可作为与肝癌的主要区别。然而不论在术前或术中,两者的真正鉴别还是有困难的,最终的诊断仍靠病理检查。
肝脏炎性假瘤虽属肝脏的炎性病变,但它不像急性和慢性肝炎那样累及肝的整体,而是以炎性肿块的形式发生在一个局限的肝段或肝叶,看上去酷似肿瘤,常使临床医生在本病与肝癌、局灶性结节性肝硬化之间造成诊断上的错误,因此,在肝占位病变的鉴别诊断过程中,尽管本病罕见,临床医生不应忽视本病存在的可能。
【临床表现】
肝脏炎性假瘤发病年龄无一定规律,综合文献中有完整资料的17例,男12例,女5例,年龄分布在1~61岁。病程最短20天,最长者36个月。和肺炎性假瘤不同的是,肝脏炎性假瘤病人一般无症状或症状较微,主要的症状有上腹部疼痛,不明原因的发烧,上腹包块,体重减轻;有的病人伴有消化道症状,如恶心,餐后上腹饱满感,个别病人如病变累及肝门胆道可出现黄疸。发病部位以一侧肝叶受累居多,也可两叶同时受累,多为单发,个别病例可以多发。
据另一组总结归纳的52例文献报道的病例分析,以男性多见,约占70%,年龄最小10个月,最大83岁,平均37岁。以发热、右上腹疼痛、肝区扣击痛,体重下降和右上腹肝区肿块等为最常见的症状和体征。
病灶大多数位于肝右叶,以单发为主,少数可多发,最大可达25cm,最小1cm。
【特殊检查及诊断】
肝脏的影像学检查均显示明确的占位性病变。B超检查可见肝内不均质回声,病变部位呈低回声,边界清楚而无晕环,形态可呈圆形、楔性或斑片状,其后方回声无改变。如果肝脏炎性假瘤与腹壁有粘连常可在B超上发现。
常规CT增强扫描可以发现病灶,但定性很难,往往误诊为肝细胞性肝癌。随着螺旋CT的出现,可以一次屏气完成全肝扫描,扫描速度快,特别是在增强造影的不同时期完成扫描,可以动态观察病灶的血供特点,从而有利于定性。肝脏炎性假瘤因无大量肝动脉供血,因而在CT增强动脉期扫描时无强化表现,仍表现为低密度灶,边界不清。在门脉期及延迟期扫描时,因炎性假瘤周边有较多的纤维组织包绕,因而其边缘可有强化表现,而且边界也显示的更加清晰,甚至有些病灶因周边纤维组织较多,强化后和肝实质密度一致,因而可产生病灶缩小的感觉。门脉期和延迟期病灶边缘强化以及纤维分隔的形成是炎性假瘤的常见表现,CT动态增强扫描和螺旋CT多期扫描可充分反映肝脏炎性假瘤的血供特点和病理特征,因而在诊断及鉴别诊断中有很大价值。
在B超和CT检查仍不能判定其性质时,血管造影对诊断的确立可能有所帮助。肝脏血管造影或核素肝血池显像为低血管性病变。通常无肿瘤性血管生存。也无动、静脉瘘,血管湖等提示恶性肿瘤或肝血管瘤等的病理改变。尽管有这些理论上可供参考的影像学表现,但临床上手术前能够明确诊断者则很少。常常难以明确地与肝癌相鉴别。往往需要手术切除后通过病理学检查而获得最终的诊断。
实验室检查常可发现周围血象白细胞和中性比例增高,血沉加快,C反应蛋白升高和贫血。AFP多为正常,个别病人AFP可以升高,HbsAg多为阴性。白细胞总数可以轻度升高或正常。在诊断肝脏炎性假瘤时遇到同时有AFP升高的病例,更难与肝癌相区别。至于肝脏炎性假瘤同时伴有AFP升高起机制尚不清楚。推测可能是当胎儿出生时所有的肝细胞都有合成AFP的功能,但随后越来越少数的肝细胞保存此功能,炎性假瘤是肝脏的局限性炎性肿块,在其发生发展过程中使保存有合成AFP功能的肝细胞或细胞群增生,因而出现血清AFP增高的现象。
当临床高度怀疑为肝脏炎性假瘤时,为进一步明确诊断可以考虑在B超引导下细针穿刺行细胞学检查(多点穿刺取材)。有对临床上怀疑本病而通过经皮肝脏穿刺活组织病理检查而成功获得诊断的报道。
【治疗】
对于本病的治疗尚存在争议,有学者根据其疾病的实质属于炎性改变这一点认为内科治疗似乎更恰当,特别是当患者经过病灶活检做出肯定的诊断时。由于预后良好,保守治疗是有效的。甚至有人提出可不必急于处理,只需密切随访观察。然而,目前大多数肝脏炎性假瘤手术前无法获得准确的诊断,可被怀疑为肝母细胞瘤或其他恶性肿瘤,往往需要剖腹探察。因此手术治疗仍是肝脏炎性假瘤的主要治疗方法。手术治疗的主要目的是明确诊断,切除病灶。
肝脏炎性假瘤多为单个病灶,绝大多数位置浅显易见。手术治疗时根据病灶的位置及范围而定,可行局部切除或肝叶、段切除。不能完全切除的炎性假瘤应行活检而明确病理诊断,手术后可行抗生素及激素等内科治疗。本病预后较好。
第十三节 肝脏畸胎瘤
小儿时期的畸胎瘤不少见,多发生于骶尾部、腹膜后、卵巢、睾丸和纵隔等部位。也有发生于肝脏者。肝脏畸胎瘤 (teratoma of the liver)极少见。Misick最早报告于1898年,是一例6周男婴,发生于肝右叶的囊实性混合存在的肿瘤。近年来报道有所增加。
【病因及病理】
一般认为在人类发生过程中,特别是在胚胎时期,部分具有全能发展能力的细胞从发育的整体中分离或脱落,如发生于胚胎的中、晚期,这些具有多能发展潜力的细胞在某些因素的作用下会分化、发展,最终成为具有三种胚胎组织的畸胎瘤。如果发生于肝脏内,则形成肝脏畸胎瘤。其本身是一种真性的肿瘤,由三个胚层的组织构成。
肝脏畸胎瘤多为分化成熟的肿瘤组织,呈囊性结构。瘤内可含有肝脏、骨骼、软骨、肌肉、皮肤毛发等组织。随着病程的发展,肿瘤可以不断生长甚至发生癌变。
【临床表现及诊断】
最常见为右上腹部的肿块,可呈囊性或囊实性。患儿一般情况往往较好。对于突然生长迅速,浸润范围较广者应该考虑恶变的可能。极个别由于压迫胆管而出现黄疸者。
腹部X线检查,可见肝区的占位病变,肿瘤内如果发现有骨骼、牙齿等影像则能够明确诊断。B超、CT及MRI等可以更清楚地了解病变的范围和性质。见图20,图21。
应该常规进行AFP和HCG的检测以判断是否有癌变。

图20:(1)(2) CT增强扫描三维呈像示肝脏畸胎瘤及其其清晰的血供

图21:肝脏畸胎瘤的手术中所见
【治疗】
治疗的第一选择为尽早手术切除肿瘤,以防止因延误时间而导致的可能的癌变发生。如果为恶性畸胎瘤则要求在手术后常规进行1~1.5年的化疗。选用化疗药物可为顺铂、长春新硷和博来霉素。
第十四节 肝脏肿瘤切除手术
在外科手术的发展史上,由于肝脏是单一器官,结构复杂,多种血供和胆道系统并存,组织脆,手术时极易发生大出血,相对于其他手术,肝脏外科手术的发展是缓慢的。1888年Carl Langenbuch首先施行成功的肝左叶切除,因此Langenbuch被认为是有目的地施行肝切除术的第一位外科医生。Lucke(1891)首次报告从肝左叶切除一肿瘤而Wendel(1911)则切除肝右叶。1889年Konig首次切除小儿肝脏的囊性肿瘤,1894年以色列医师成功切除儿童肝脏恶性肿瘤。自上世纪40年代,随着对肝脏的解剖、生理的深入了解,抗生素的问世和输血技术的进步,以及麻醉技术的改进,大大推进了肝脏外科的发展,至上世纪50年代国际 上已经能够进行包括肝右三叶切除的多种复杂肝切除手术。
我国肝脏外科起步较晚,上世纪50年代尚无肝切除的报道,至1962年全国共有不足200例的手术病例报道。但近三十余年以来,我国的肝脏外科得到迅速的发展。特别近年来影像学检查方法的进展,使很多肝肿瘤病人得到了早期诊断和早期的治疗,使肝肿瘤的长期生存率有显著的提高。B超、CT、MRI及DSA血管造影技术的广泛临床应用,手术前可以准确地了解肿瘤的大小、数目、侵及肝脏的部位、判断肿瘤的性质、以及肝周围情况等可靠资料,为选择手术方式、估计预后以及术后随访等提供了依据。目前,对于成人肝癌发病率极高的我国,无论是微小肝癌的早期诊断和治疗,还是巨大肝癌的成功切除,肝脏外科手术已稳居国际先进水平。
然而,由于小儿肝脏肿瘤发生率低,每一医疗单位的经验少。小儿巨大肝脏肿瘤的比例高,切除率较低,因此相对于我国成人肝脏外科的飞速发展,小儿肝脏外科的发展是晚的。近年来随着小儿麻醉和小儿外科整体水平的提高,特别是专业发展的逐渐细化,病人的集中治疗化及成人肝脏外科成就的借鉴等,也极大促进了我国小儿肝脏肿瘤手术治疗的发展和进步。尽管病例数远较成人少,但巨大肝脏肿瘤的切除率已不亚于成人肝胆外科。近年,国内小儿外科已有较多的报道。笔者近年成功切除最大肝脏肿瘤达4.8千克,为右三叶肝肿瘤切除的肝脏腺瘤,同时进行过多例巨大的肝母细胞瘤手术,瘤体的重量占到体重的十分之一至八分之一。比例最大者甚至达到体重的五分之一,此为一例6个月患儿,切除瘤肝1.55千克, 而手术前患儿带瘤时体重则为7.8千克。
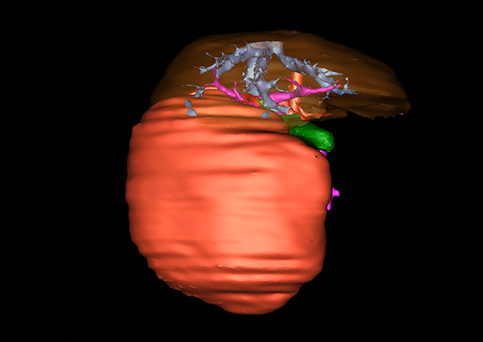
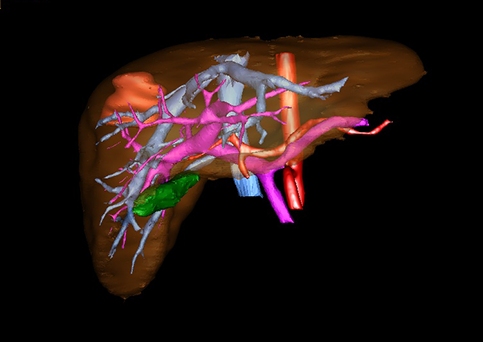
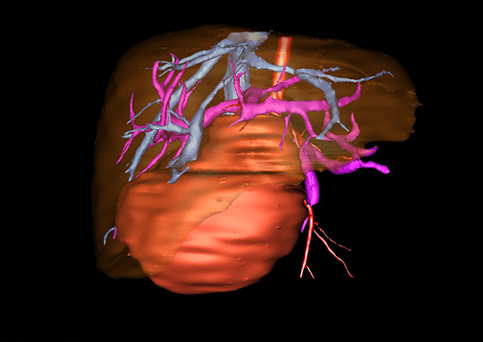
近年来由于数字医学的发展,基于可视化三维重建技术的计算机辅助手术系统极大推进了小儿肝脏肿瘤的精准手术的进步。可以立体透视肝脏解剖、精确掌握肝段的边界、精确测算肝段乃至任意血管所支配的功能体积、准确定位病灶及其与邻近血管的解剖关系,最终对不同手术方案进行比较、筛选和优化。因此,计算机辅助手术规划系统是实现精准肝切除的有力辅助工具,是未来数字外科、精准外科等21世纪外科新理念的重要技术支撑。
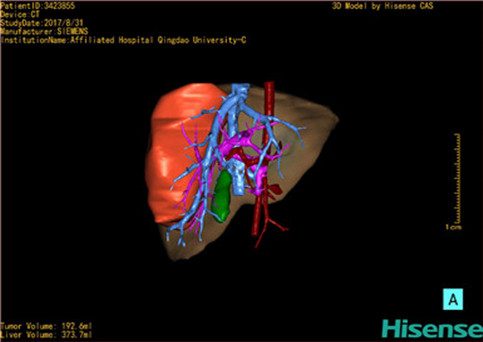
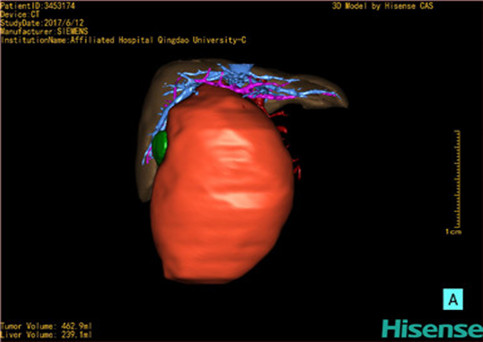
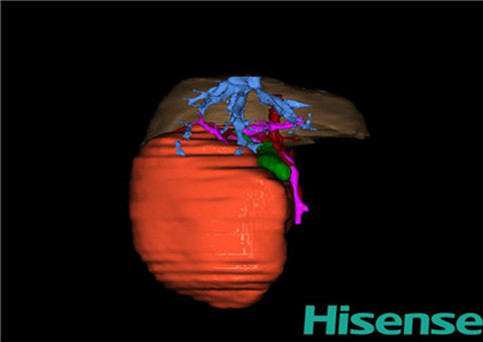
计算机辅助手术规划系统具有良好的操作可行性、计算准确性和三维显示效果,可半透明、交互式显示真实的肝内立体解剖关系和空间管道变异,准确计算肝内管道的直径、走行角度,两点间的垂直距离,和任意血管的支配或引流范围等传统二维影像无法获取的信息,有助于实施个体化手术,提高了手术的确定性、预见性和可控性。计算机辅助手术规划系统可直观显示预留肝脏的结构和功能,并可通过虚拟切割功能辅助术者对手术方案进行蹄选和优化,系统评估手术风险和制定对策,改变了部分二维规划的术式和切除范围,使部分二维规划认为不能切除的患者成功手术,提高了手术的根治性、安全性和病变的可切除性,更加符合精准肝脏外科的术前规划要求。详见第11章。
一、小儿肝脏肿瘤切除的解剖生理特点
(一)小儿肝脏的相关解剖特点
小儿肝脏呈红褐色,组织厚而脆,血管丰富。小儿肝脏相对较大,约占体重的1/20~1/16, 年龄越小,所占比例越大。而成人则占1/36。5岁时肝重约650克,占体重的3.3%,到青春期,重约1200克,只占体重的2.5~3.0%。 正常婴幼儿的肝脏在锁骨中线右肋缘下2cm可触及。剑突下更易触及,4岁以后逐渐缩入肋下,仅极少数可在右肋下触及。与成人胆囊突出于肋下不同,小儿胆囊被肝叶遮盖,一般不能触及。小儿肝脏血管丰富,肝细胞和肝小叶分化不全,容易充血,对感染和毒素的抵抗力低,反应特别敏感。在新生儿期较严重的败血症即可引致明显的黄疸。但小儿、特别是新生儿肝细胞再生能力强,肝内结缔组织发育较差,较少发生肝硬变。
小儿肝脏左叶较大,肝脏再生能力远比成人旺盛。这一特点尤以新生儿为甚。小儿在肝脏广泛切除手术后,反应较轻。可以耐受切除肝脏80~85%的大比例肝脏切除手术而无明显的肝功能衰竭表现。笔者曾经验1例45天日龄4.0千克体重的肝脏肿瘤患儿,手术切除450克的右三叶肝母细胞瘤瘤肝,约占整个肝脏体积的80%左右。手术后出现黄疸,但两周后自然消退,1个月后复查,肝功已恢复正常。一般1岁以内的小儿在术后2周,体重开始迅速恢复,6周后体重可以超过手术前的水平,体重增加的速度与正常儿无差别。术后肝脏再生率与术后体重增长率同步增长。术后6周内小儿肝脏再生速率相当于成人的4倍。术后2月可恢复到术前肝脏的体积。肝脏切除后,肝扫描观察残肝的形态,成人以增大横径为主,呈椭圆形,小儿则近似球形。患儿年龄愈小,肝脏切除范围愈大,愈明显。这是由于再生能力旺盛,以最小的表面积容纳最大的体积所致。
(二)肝脏的分段
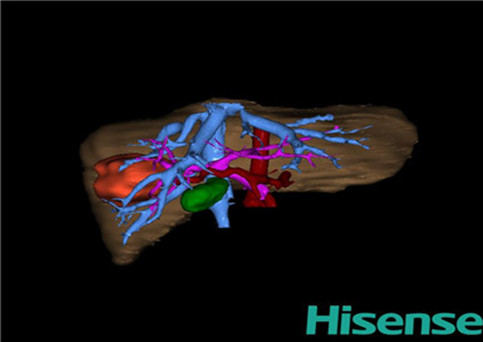
通过对肝内血管、胆管分布规律的研究,可以发现肝内有若干平面缺少管道的分布,这些平面是肝内分区的自然界限,称为肝裂。通过肝内静脉系统灌注腐蚀标本观察,肝脏内存在6条明显裂隙,借助这些裂隙,解剖学上将肝脏分为左、右半肝。并进一步分为五叶四段,即左外叶、左内叶,右前叶、右后叶和尾状叶。左外叶和右后叶又各分为上、下两段。该分类方法主要以肝静脉的走行为依据。
具体如下: ①正中裂, 肝膈面自胆囊切迹向后上方达肝左静脉进入下腔静脉处,肝脏面以胆囊窝和腔静脉窝为界,将肝脏分为左右两半,裂的平面内有肝中静脉经过。②左叶间裂,肝膈面以镰状韧带附着线稍偏左为界,脏面以左纵沟和静脉韧带为标记、将左半肝分为左外和左内叶,裂内有肝左静脉的叶间支经过。③左段间裂,自肝左静脉进入下腔静脉处,斜向外侧抵肝左缘的后、中1/3交界处,将左外叶分为上、下段,裂内有肝左静脉段间支经过。④右叶间裂,位于正中裂右侧,自肝右下缘相当于胆囊切迹与肝外缘的外、中1/3交界处,斜向右后上方达肝右静脉进入下腔静脉处,在肝表面无明显标记,将右半肝分为右后叶和右前叶,裂的平面内有肝右静脉通过。⑤右段间裂,肝脏面起自肝门的右切迹,横过右后叶抵肝右缘中点,将右后叶分为上、下两段。⑥背裂,位于肝脏后上缘中部、尾状叶的前方、是肝静脉进入下腔静脉处,将尾状叶和其他肝叶隔开。
为了更便利地指导床应用,目前国际上肝胆外科的临床医生多采用肝脏Couinaud分类方法。该方法主要以肝门静脉的走行为分类基础,将右前叶分为上下两段,即肝脏分为8段:尾状叶为第Ⅰ段,左外叶分为Ⅱ、Ⅲ段,左内叶为第Ⅳ段,右前叶分为第Ⅴ、Ⅵ段,右后叶分为第Ⅶ、Ⅷ段。了解这些肝脏的分叶和分段法,对于肝脏疾病的定位和手术中血管、胆管系统的正确处理都具有重要的指导意义。见图22。
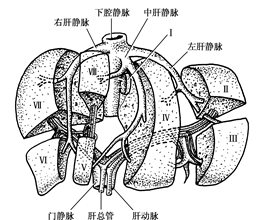
图22 :肝脏Couinaud分区方法
肝脏分段的最初研究基于尸体解剖的离体肝脏标本进行,由于当年血管灌注解剖技术水平和解剖尸体例数所限,每一种分段法不可避免存在局限性, 并存有不同的争议。比如,对于被广泛应用的Couinaud分段法,真实的解剖结构与理论上的肝段分界有一定的差异,且更为复杂;这一点在通过数字医学研究获得的活体肝脏血管三维影像大数据量的分析统计结果面前显得尤为明显。根据1260例正常人类数字肝脏的三维重建影像,以精准肝脏外科基本要求的功能性肝脏单位的门静脉走行及分支为基准董蒨提出进行Dong’s肝脏分段。
(三)肝脏的血液供应与回流
肝脏是机体大器官中血液供应最复杂的,分别由肝动脉和门静脉供血,而经肝静脉和多数的肝短静脉引流血液回心。
在胚胎期、肝脏有3条动脉供血,分别来源于胃左动脉、腹腔动脉和肠系膜上动脉,这3条动脉分别供应肝脏的不同部位。出生后,一般保留一条动脉,大部分为起源于腹腔动脉的肝动脉,由其分出左、右肝动脉供应左、右半肝。偶尔也可见起源于胃左动脉的动脉或起源于肠系膜上动脉的动脉。但也有2条动脉并存的情况,如起源于腹腔动脉和起源于胃左动脉或起源于腹腔动脉和起源于肠系膜上动脉,而起源于胃左动脉和起源于肠系膜上动脉的2条动脉同时存在的情况比较少见。此外,还有5%的人像胚胎期一样,3条动脉同时存在。
门静脉由肠系膜下静脉、脾静脉、肠系膜上静脉汇合而成、回收来自腹腔脏器的血液。门静脉内没有瓣膜。在肝十二指肠韧带处,门静脉位于肝动脉和胆总管后方。在肝十二指肠韧带游离缘,一般没有门静脉的属支。在十二指肠第一部后方,有来自胃、胰十二指肠的静脉直接注入门静脉。在第一肝门的位置,门静脉分为粗短的右干和细长的左干,门静脉左干和右干分别发出1-3条小静脉至尾状叶及左右段,有部分病人的右前叶门静脉也直接从门静脉主干发出,或来自门静脉左干的横部。
肝静脉分为肝左静脉、肝右静脉和肝中静脉。根据国人的解剖统计资料,肝左、中、右静脉分别开口进入下腔静脉者占56.3%,肝中静脉与肝左静脉形成共干后进入下腔静脉者占40.6%,而同时有4个开口于下腔静脉者占3.15%,其中另一开口为左后上缘静脉。这些正常变异在肝切除手术时有重要意义。肝右静脉是肝静脉中最长的一条,位于右叶间裂内,它主要收集来自肝右后叶(第Ⅶ、Ⅷ段)的血液,也回收部分肝右前叶(第Ⅴ、Ⅵ段)的血液。肝右静脉的分支类型、粗细和分布范围变化较大,与肝中静脉和右后侧肝短静脉大小的关系密切。肝中静脉位于正中裂内,接受来自左内叶和右前叶的血液。有时,肝中静脉也接受来自右后叶下段的部分回血。肝左静脉本身不在肝左叶间裂内,而是与之呈锐角交叉,在裂内只是它的一个分支,它接受来自左外叶(Ⅱ、Ⅲ段)的血流以及左内叶(第Ⅳ段)的部分血流。此外,还有直接开口于下腔静脉左前壁和右前壁的肝短静脉,一般有4-8条,最少3条,最多可达31条。开口于左前壁的肝短静脉主要接收来自左尾状叶的静脉回流,开口于右前壁的肝短静脉主要接收来自右尾状叶和肝右后叶脏面的静脉回流,此组肝短静脉中,经常有1-2条比较粗大的静脉,在右叶的巨大肿瘤病例,其口径可更大,开口于下腔静脉远端右前壁,手术中应引起高度重视的。
大量的肝脏解剖发现肝脏的血管系统的正常变异非常多见,当合并肝脏肿瘤存在时,肝脏的血管也往往会发生较大的变化,个性化的精准术前判断和手术中指导对外科医生就显得愈加重要。
二、小儿肝脏肿瘤切除手术相关问题
(一)手术适应征
小儿肝脏实体肿瘤大多需手术治疗,其中肝脏恶性肿瘤有肝母细胞瘤、肝细胞癌、间质性肉瘤、转移性恶性肿瘤等。良性肿瘤有间质性错构瘤、畸胎瘤、肝细胞瘤等。
肝脏海绵状血管瘤及婴儿型血管内皮瘤为小儿常见的肝脏良性肿瘤,有自然消退倾向。如无症状,可暂作观察。但如果已引起心血管系统损害,出现心衰或血小板减少(Kasaback Merritt综合征),经皮质类固醇治疗无效时,应根据具体情况选择肝切除或肝动脉栓塞、结扎等处理方法。局灶性结节性增生由于与其他肝脏良性肿瘤难以鉴别,需细针抽吸活检或剖腹探查。如果诊断明确又无症状,可暂时不作进一步手术。如诊断不明确,则需行肿瘤切除。
(二)手术安全性判断及禁忌征
当临床发现肝脏肿瘤后,临床医生面临的主要问题是根据各种影象学检查并结合肝脏功能对如下两个主要问题进行判断。 ①是否能够安全地完成肿瘤切除;②当肿瘤肝脏切除后,残留的肝脏是否能够维持机体对肝脏功能的需求。
血管造影具有重要的意义,可为手术提供非常有效的影像学指导,但技术要求高,操作较复杂,且给患儿带来一定的痛苦。如果无法进行肝血管造影,笔者体会增强的CT检查是必须的,也是十分有效的。增强CT可以更清晰地看出肿瘤的界限,特别是根据肝血管的显影,判断出肿瘤与门静脉及肝静脉的关系以在手术前较准确地估计出手术成功切除的可行性。然而,由于影象学检查可能存在误差,并且小儿肝脏肿瘤虽然体积较大,但多位于右叶,可具包膜或假包膜,有较高的切除率,因此肝脏肿瘤能否切除,往往最终需经手术探查来判断。小儿肝脏恶性肿瘤的术前化疗可使肿瘤体积缩小、血供减少,从而减少手术并发症、提高切除率、使一些原先认为无法切除的肿瘤亦有完全切除的可能,因此对于部分认为不能一期切除的巨大肿瘤也不应轻易放弃,而应在积极化疗后争取延期手术切除。由于小儿肝脏具有极强的再生能力,切除的瘤肝可达80~85%, 手术后多可恢复正常肝功能。
一般认为原发性肝脏恶性肿瘤出现如下情况时,不宜手术治疗:①已有肺、骨、脑或腹腔淋巴结等处转移;②病变为弥漫性或多灶性,累及半肝以上,无肝硬化切除量大于70%~80%,有明显肝硬化肝切除量大于50%;③肿瘤侵及第一、二、三肝门;④门静脉主干有癌栓形成;⑤有明显黄疸、腹水或恶液质。但近年来由于肝脏外科技术和术中、术后生命支持体系的进步,对于小儿病例,以上的指征已经明显放松。如即使有单个部位的转移或病变超过半肝,也有手术成功而获得长期存活者。
(三)术前准备
1.由于肝脏切除手术较为复杂,手术中生命体征的维持尤为重要。尤其是小儿的巨大肝脏肿瘤切除手术时,应与麻醉师进行细致的手术前讨论,制订缜密的麻醉与手术方案。进入手术室后,置桡动脉插管,经颈部置管入上腔静脉,准确监测动脉压、中心静脉压,并便利输血、输液。大量输液时应采用上肢静脉。
2.肝脏肿瘤术前应详细检查全身情况及肝功能,包括血清蛋白、胆红素、凝血功能及各项酶学检测。
3.根据影像学检查结果进行手术可行性的判断。现代肝脏肿瘤治疗原则应为根治性切除肿瘤,确保肝功能的有效代偿,达到治愈或延长生存期提高生存率的目的。对于小儿肝脏肿瘤,手术完整切除仍是其治疗最重要的内容。术前全面了解肝脏血管结构是巨大肝脏肿瘤和复杂部位肿瘤外科切除的先决条件,能缩短手术时间,增加手术的准确性,对手术方案的选择、制定以及术中的具体处理有重要影响)。血管造影可获得清晰的肝脏血管影像,可为手术提供非常有效的影像学指导。但技术要求高,操作较复杂,且给患儿带来一定的痛苦,所以并不普及。
随着计算机技术及影像检查技术的不断发展,以精确的术前影像学和功能评估、精细的手术操作为核心的精准肝切除技术日益受到重视。基于数字医学的计算机辅助手术技术(computer-assisted surgery,CAS)则是实现肝脏精准手术操作的基础。计算机辅助手术系统(CAS)可将术前二维(two dimensional,2D)的CT/MRI影像数据进行三维(three dimensional,3D)重建,建立个体化的肝脏三维解剖模型,清晰显示肝脏内脉管系统的走行及解剖关系,还原病灶与其周围脉管结构的立体解剖构象,准确地对病变进行定位、定性和评估,制定合理、定量的手术方案,实施个体化的肝脏血管取舍分配方案及实施精准肝脏手术。一般认为CAS包括:创建虚拟的患者的图像;患者图像的分析与深度处理;诊断、手术前规划、手术步骤的模拟;术中实时导航。应用本技术后,由于可以更清晰地看出肿瘤的界限,特别是根据肝血管的显影,判断出肿瘤与门静脉及肝静脉的关系以在手术前较准确地估计出手术成功切除的可行性。以往部分根据普通强化CT判断无法手术的病例而被评估为可以成功切除并手术成功。
图23:肝中叶肿瘤二维CT图像
4.存在低蛋白、贫血及凝血功能不良者,应进行保肝,给予高蛋白、高糖和高维生素的补充。静脉补充血浆或白蛋白、维生素B、C、K等,必要时少量多次输血。术前一般要求蛋白总量高于60g/L,白蛋白高于30g/L,白/球蛋白比值大于1,凝血酶原时间高于75%,无肝细胞性黄疸。
5.根据肝切除范围备血,切除范围大或肝功能不良者,宜备新鲜血。术前1~2天给予预防性广谱抗生素。
5.手术日晨起后温盐水灌肠一次,术前置胃管。术中放置导尿管,监测尿量。
6.巨大肝脏肿瘤切除时,可以采用低温麻醉。但对于新生儿或小婴儿术前、术中应注意保暖,避免硬肿症的发生。
(四)麻醉与手术切口
麻醉应采用全身麻醉方法,可为气管内插管气体吸入麻醉或气管内插管静脉复合麻醉。取仰卧位,腰部略垫高。如肿瘤位于肝脏右叶,右侧腰背部垫高45°。
(五)术中常见问题及处理
1.术中血管损伤大出血 由于肝脏的血供系统是机体大器官中最复杂的,在施行肝切除术时外科医师最担心的是大出血,也是最危险的并发症。大出血可因对肝脏解剖不够熟悉,肿瘤体积大暴露欠佳,以及操作中误伤血管造成的。最常见的血管损伤有以下几种情况:
(1)肝门静脉损伤,肝门静脉在第一肝门处分为肝左右门静脉分支,进而入肝分布于肝实质中。由于门静脉直径粗、壁薄,极易损伤。如果发生破损,可以立刻阻断第一肝门,找到破损处进行缝合修补。
(2)肝短静脉撕裂:肝短静脉是由右半肝下部和肝尾状叶直接进入下腔静脉的静脉分支,通常称第三肝门。肝短静脉数目可为数支至数十支、粗细不一,且壁较薄。特别是巨大肝肿瘤存在时,肝短静脉会更粗。当行右半肝或肝尾状叶切除术时以及右肝后侧游离时可造成肝短静脉的破裂,甚至连同腔静脉壁撕裂伤,造成大出血。术者宜即可用手指压迫出血部位,吸净积血。助手以大小合适的纱布球压迫出血部位上下端的腔静脉,再分别试行放开按压的手指,确定出血部位。在直视下用无创伤性血管缝合线进行缝合修补。如果已安置肝上、肝下腔静脉阻断带,亦可收紧阻断带,同时阻断第一肝门,使该段下腔静脉处于无血状态,更便于修补。
(3)肝静脉损伤:右、中、左肝静脉是肝脏血液回流的最主要血管。肝右静脉短而粗、壁薄,紧贴下腔静脉,肝外部很短,其余部分深埋于肝实质内。肝左静脉较浅表,在镰状韧带膈面附着处的延长线的左侧、壁薄。在作右、左半肝切除时过度牵拉肝组织引起肝静脉撕裂伤,或由于处理第二肝门时损伤肝静脉,亦可因肝静脉的结扎线滑脱而引起大出血。在第2肝门处理肝中、肝左静脉时,必须注意约有60%的肝中静脉与肝左静脉合干后汇入下腔静脉,仅需结扎一支时切记避免误伤另一支静脉。
由于第二肝门位置较深,暴露欠佳,不易直接看到破损处。遇此情况,术者可用示指伸至下腔静脉后方向前顶着下腔静脉,拇指压着肝静脉撕裂处,两指捏紧,吸净积血后用丝线结扎或缝合,如不便缝合修补,亦可在阻断肝上、下方的腔静脉及第一肝门后,切除肝叶后在无血情况下修补破损静脉。
2.对血循环的影响 在切除较大的右肝肿瘤时,在分离肿瘤向上牵拉肝脏时往往使下腔静脉发生扭曲、压迫,使回心血量减少而发生血压下降,心率加快等循环紊乱等问题。特别是在切除肿瘤时阻断肝门,使回心血量更少,血压下降更明显。遇到此种情况应采取分次阻断肝门的办法,不使病人长期处于低血压状态。另外应与麻醉师配合快速输液,保持有效循环量的同时切除肿瘤,强调肝切除时病儿输液径路应建在上肢。
3.肝断面出血 在切除肿瘤后去除肝门阻断带,肝断面可有较广泛的渗血。若有小静脉或动脉出血点可用丝线缝扎止血。若有小的渗血,也可用热盐水纱布按压于肝断面,或以氩气刀电凝止血,细小的出血点多能停止出血。断面再用镰状韧带或大网膜覆盖,也可减少术后出血。
4. 低体温 由于肝脏手术暴露范围广、创伤打击大,极易引致低体温的发生。对于成人或大龄儿一般不会引起严重的后果,但新生儿由于其脂肪代谢和皮下脂肪结构的特殊性,遭遇低温时会出现硬肿症,而后者本身就可引起严重的问题, 甚至是致命的。因此,新生儿肝脏手术时一定注意保温的问题。
(六)手术后处理
1.密切监测生命体征,血生化指标,警惕术后 出血、观察心、肺、肝、肾主要脏器功能。常规给予吸氧。
2.在肝切除手术时由于常常需要进行肝门阻断,手术后患儿常存在门静脉系统的淤血而引致胃肠功能恢复不良。因此禁食、胃肠减压尤为重要,一般于术后2~3天至胃肠功能恢复后再予以进食。
3.禁食期间每日输葡萄糖液和生理盐水,保持水、电解质及酸碱平衡。巨大肝肿瘤切除者,要预防肝代谢异常所致低血糖、低白蛋白血症和低凝血酶原血症。宜用10%葡萄糖液内加电解质作为输液。在术后1周内每日补充白蛋白,使之维持在30g/L以上,补充维生素K、B、C,必要时输新鲜血。
4.继续使用抗生素,预防感染。保持腹腔引流通畅,密切观察引流的量与性状。如引流量逐日减少,无出血或胆瘘,在术后5天内逐渐拔除引流管。
(七)术后并发症的预防与处理
1.腹腔内出血 应补充新鲜血、新鲜血浆、凝血酶原复合物或纤维蛋白原,以及其他凝血药物。如出血量大,出现低血容量性休克,保守治疗无效时,应剖腹探查,手术止血。
2.肝功能不全 小儿肝脏基础情况较好,肝功能不全仅出现在正常肝组织剩余过少、出血输血过多、肝门阻断时间过长时,常于术后1~2天即出现,表现为高热、烦躁、嗜睡、昏迷、黄疸等;白球蛋白比例倒置、转氨酶升高、凝血功能异常、总胆红素升高,最后导致肝功能衰竭。如出现肝功能不全,应加强保肝。充分吸氧,避免使用肝脏毒性较大的药物,补充富于葡萄糖和维生素K、B、C的液体,并纠正凝血功能的障碍,可给予皮质类固醇。
3.胆瘘 多为肝脏断面的小胆管未予严密结扎所致。表现为胆汁从切口或引流管流出,量随进食而增加。处理方法为保持引流通畅,胆瘘于10余天至数月后可自愈。除非术后早期发生弥漫性胆汁性腹膜炎,一般不需剖腹修补胆道。
4.腹腔内感染 如术后持续发热,应怀疑膈下或拉拢缝合的肝脏创面内有血液、胆汁或渗出液积聚、继发感染。即使引流管通畅者亦可发生,可由B超或CT检查获得诊断。范围小者可应用静脉抗生素治疗,较大者可在超声引导下穿刺抽液或穿刺置管引流,多可治愈。
5.肝切除后低蛋白血症, 这是较常见的手术后并发症,其中以白蛋白减少为主。原因为肝切除后肝脏白蛋白的合成能力降低、蛋白质消耗量增大,另外氨基酸的需要量增加。并且小儿低蛋白血症的恢复较成人为晚,因此应该注意手术后积极补充白蛋白或血浆。
6.水钠滁留性水肿 对于巨大肝脏腺瘤的病例,肿瘤切除后可能发生水肿,当排除肝功能低下和低蛋白血症后可考虑为水钠滁留性水肿。发生原因可能为巨大肝脏腺瘤被切除后,以往在肝脏被破坏的调节水电解质平衡的激素破坏减少,引起水钠滁留所致。适当服用利尿药物,随着肝脏功能的恢复和水电解质平衡新的调节平衡的建立,水肿多会自行消退。
三、主要肝叶切除手术
(一)右半肝切除术
右半肝切除术(right Semi- hepatertomy)适应于位于肝脏右叶的肿瘤,包括肝癌、胆囊癌、肝门肝管癌和肝血管瘤,以及肝中部粉碎性损伤无法缝合修补者。小儿肝脏多无硬化等病变,再生能力强,所患肿瘤往往体积大,但局限在半肝内。小儿肝脏肿瘤好发于右叶,右半肝切除较常用。右半肝切除包括Couinaud分类的Ⅴ、Ⅵ、Ⅶ、Ⅷ和Ⅰ段的右侧小部分。
【手术切口】
一般采用右上腹经腹直肌或右上腹旁正中切口探查。当肿瘤较大时可取“人”字形偏右的切口。由于小儿的腹腔横径较大,即使婴儿或儿童行右半肝或左半肝切除术时,也可不必开胸。见图24(1)。
(1)切口,(2)切断右三角韧带,(3)切除胆囊,显露第一肝门(4)接扎,切断右肝动脉右肝管 及门静脉右支(5)结扎切断肝短动脉(6)显露右肝静脉(7)切开离断肝脏(8)结扎切断右肝静脉,离断右半肝
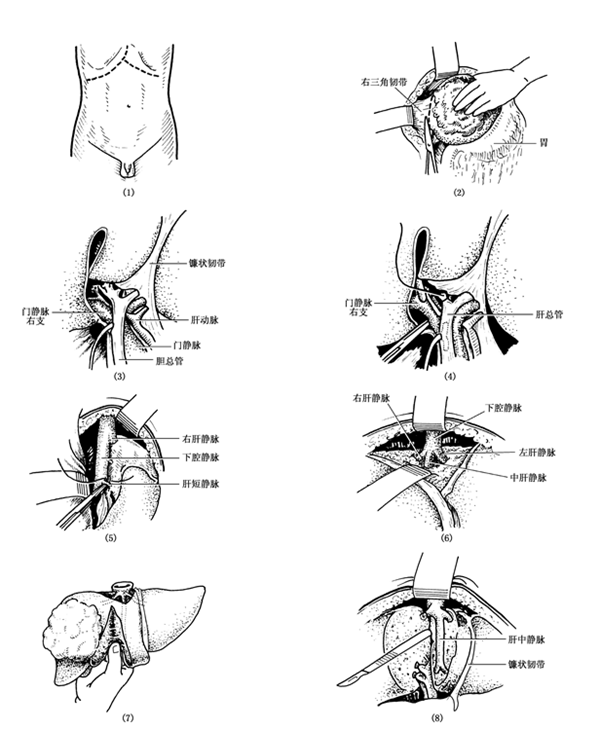
图24:右半肝切除术示意图
【操作步骤】
1、游离右半肝 先切断肝圆韧带和镰状韧带,轻轻向下拉开肝脏,再切断右三角韧带和冠状韧带。切开右三角韧带前层(肝膈韧带)时,勿损伤膈面的肝裸区,钝性分开肝裸区达肝后下腔静脉。然后,轻轻向内上方翻转右半肝,靠近肝脏剪断冠状韧带后层(肝肾韧带),分离肝肾韧带和肝裸区时,注意勿损伤右肾上腺及其血管。分离右半肝时,可能出血较多,操作要仔细,并注意防止撕裂汇入下腔静脉的肝短静脉。详见图24(2)(3)。
2、处理第一肝门 先将胆囊管和胆囊动脉结扎、切断。当切断胆囊管和胆囊动脉后,即可清楚显示出第1肝门的解剖结构。然后分离、结扎、切断右肝管和肝右动脉,显出门静脉右支。因为门静脉右支较短,在肝门深处分出,位置较高,故应仔细分离肝组织,将血管结扎、切断。当门静脉右支太短、太深时,可先行结扎,暂不切断,以免引起误伤;待右半肝实质分离完毕,验证门静脉右支结扎部位正确后,再予切断,残端加作缝扎。详见图24(4)。
3、处理第三肝门 由助手将右肝向左向上翻起,仔细分离、切断右肝冠状韧带后层残留部分和肝肾韧带,即可显出由肝右后叶直接回流入下腔静脉的肝短静脉。肝短静脉短小,如果肿瘤富于血管,则数目较多,肝短静脉一般有8~10支,也可达20支以上。肝短静脉较细小,壁薄,又靠近下腔静脉,撕裂后易引起大出血,故应尽量靠近肝实质处仔细结扎后切断,下腔静脉侧残端加作缝扎操作时不得过分牵拉,以防将肝短静脉撕裂,造成多量出血。详见图24(5)。右肝短静脉离断后,右肝后侧便与下腔静脉分开,在以后的切肝时可减少出血,避免损伤下腔静脉。
4、处理第二肝门 肝右静脉粗大、深埋于肝实质内,肝外行程短,将肝右叶放回原处,向下拉开,即可显露第2肝门。分离第2肝门的结缔组织,显露肝右静脉,肝右静脉一般在右叶间裂处,在下腔静脉的前壁或右壁开口,其主支距下腔静脉很近,分离时容易损伤下腔静脉,造成严重出血,故当不易分辨时,宜从肝右叶实质内分离、结扎肝右静脉。在接近肝右静脉肝外部切开肝包膜,经过肝实质用直角血管钳引过两根丝线结扎肝右静脉,再切断。详见图24(6)。肝右静脉近下腔静脉端再缝扎加固,肝静脉菲薄,处理时应十分轻柔仔细,慎防撕破。
5、切断肝脏 将第1和第2肝门处理完毕后,即可见将要切除的肝叶组织色泽变暗,和正常肝组织界限分明。行肝叶切除时,沿正中裂右缘1cm,并结合右侧肝门血管结扎后肝脏颜色改变的分界线,用电刀切开肝包膜,运用指压法、刀柄钝性分离、分别钳夹,切断肝内管道。这样,可以避免在切除肝叶时发生大出血。切肝过程中如仍有较多出血时,亦可暂时阻断第1肝门。经过该断面仅离断肝中静脉的右叶属支,避开了行走在正中裂中的肝中静脉,但在实际操作时仍应警惕误伤。最后用血管钳穿过肝右静脉底部,连同肝组织钳夹,切断和结扎。以同样方式沿下腔静脉右前壁切断残留的肝短静脉,将右半肝切下。在断肝前可沿左半肝断面边缘用肝针、可吸收线缝一排交锁的褥式缝合,控制近肝表面切缘的出血与胆瘘。详见图24(7)(8)。
6、处理断面 松去肝门阻断,用热盐水纱布垫压敷肝断面,彻底止血。此时应用氩气刀电凝创面可受到极好的止血效果。查无出血及胆瘘后,用温盐水冲洗创面。小儿肝脏柔软,肝断面可以进行部分性的拉拢缝合,游离的创面可用一片大网膜覆盖,并用可吸收线缝合固定。右膈下放置引流管,右上腹戳孔引出,妥善固定。
7、将已切断的镰状韧带和肝圆韧带重新固定于原位置,以防术后发生肝下垂。
(二)左半肝切除术
左半肝切除术(left hepatecromy) 是以正中裂为界,切除肝左外叶及左内叶。也即Couinaud分类的Ⅱ、Ⅲ、Ⅳ段。
【手术切口】
可以采用右上腹经腹直肌或右上腹旁正中切口探查。小儿肿瘤多较大,取“人”字形偏左的的切口暴露好切更易操作。 详见图25(1)。
(1)皮肤切口(2)分离左半肝(3)剪断肝镰状韧带(4)切断左三角韧带(5)剪断肝胃韧带及肝十二指肠韧带(6)处理第一肝门(7)结扎切断肝动脉与门静脉左支(8)处理第二肝门(9)结扎切断左肝静脉,沿中肝静脉左侧离断左半肝(10)分离肝实质(11)切除左半肝(12)处理肝创面
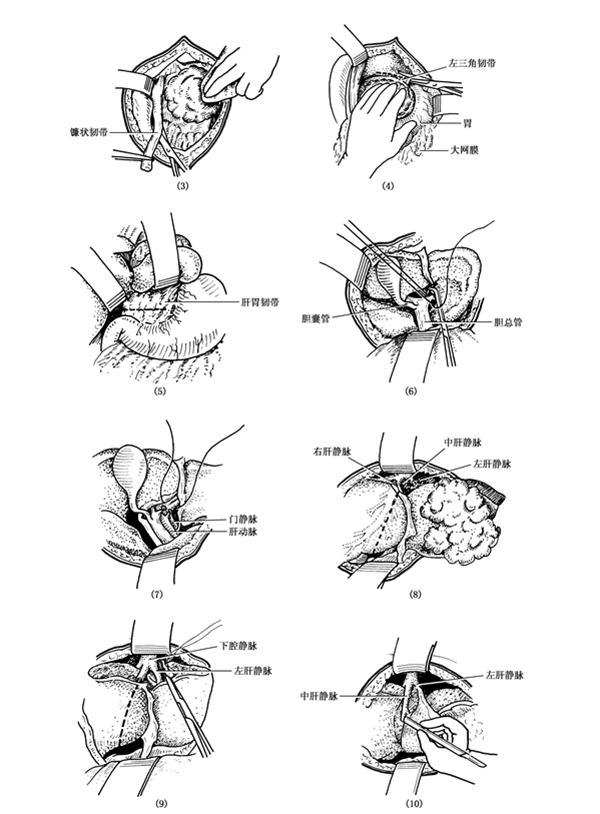

图25:左半肝切除术示意图】
【操作步骤】
1、游离左半肝:分离切断肝圆韧带、镰状韧带、左冠状韧带、左三角韧带、肝胃韧带和部分右冠状韧带,使左半肝充分游离。详见图25(2)(3)。
2、处理第一肝门:将第一肝门暴露,切开肝十二指肠韧带、分离出肝左动脉予以双重结扎、切断、近侧断端再加缝扎。在肝门横沟处剪开Glisson鞘,分离出左肝管和门静脉左干,亦予结扎。值得注意的是肝门左侧解剖较复杂,变异多。在解剖肝门时必须注意变异的可能性,在解剖清楚、确定为左肝管和门静脉左干且无向右肝的分支后,尽量靠近管道进入肝脏处结扎详见图25(4)(5)(6)。
3、处理第二肝门:将肝脏拉向下方,显露第二肝门。肝左静脉较表浅,于镰状韧带膈面附着处的延长线的左侧,在下腔静脉左侧壁切开肝包膜,用刀柄钝性分开肝实质,显露肝中静脉和肝左静脉的根部及其分叉部,经过肝左静脉基底部肝实质,用直角血管钳引过两根丝线,双重结扎,并予以切断,腔静脉侧断端再予缝扎。
详见图25(7)(8)(9),此时特别应该注意的是肝中、左静脉汇合的解剖类型可有变异,约60%的病例肝中静脉先与肝左静脉汇合,形成共干进入下腔静脉,操作中,要注意辨认,切不可误伤肝中静脉。
4、切断肝脏:当左叶血流完全控制后,沿正中裂左缘1cm,并结合左半肝血管结扎后肝脏颜色改变的界线,进行切肝。操作同右半肝切除术,肝脏面切开分离时,切面应斜向横沟左侧,达左纵沟与横沟交界处,将已结扎的门静脉左干横部和左肝干钳夹后切断、结扎与缝扎。最后在肝实质内将已结扎的肝左静脉连同周围肝组织用血管钳夹住切断、结扎,完全离断左半肝。在切除至第二肝门附近时,下腔静脉与尾状叶左侧之间有时也有许多肝短静脉相连,应仔细逐个予以切断、结扎。肝断面处理及引流同前详见图25(10)-(12)。
(三) 肝中叶切除术
肝中叶切除是指肝脏中央区的切除,包括右前叶和左内叶,保留右后叶和左外叶,切除量相当于半肝,也即Couinaud分类的Ⅳ、Ⅴ、Ⅵ段。因涉及上、下两肝中央部的管道,技术较为复杂。详见图26(1)。
(1)肝中叶切除示意图(2)结扎切断右内叶肝动脉,门静脉(3)结扎切断肝中静脉(4)切除肝中叶(5)肝中叶切除后切面(6)两侧肝断面切除并拢

图26:肝中叶切除术示意图
【手术切口】
体位、切口同右半肝切除术。
【手术步骤】
1、处理第一肝门 开腹探查后,先切断肝圆韧带和镰状韧带,再切断右侧肝周韧带,分离肝右叶,显露肝后下腔静脉。然后在第1肝门分离切断胆囊管和胆囊动脉,切除胆囊。切开肝十二指肠韧带,分离出胆总管及左、右肝管,肝固有动脉及肝左、右动脉,门静脉主干及左、右门静脉主支。沿右切迹切开Glisson鞘,在右切迹外侧可显露出右前叶的门静脉、肝动脉和胆管支,将这些管状结构结扎、切断。再沿肝门横沟向左,在左纵沟处切开Glisson鞘,可分离出左内叶的肝动脉支,并在门静脉左主支的矢状部内侧缘显露出门静脉的左内叶支以及左内叶肝管支。将左内叶肝动脉、门静脉及胆管支一一结扎、切断。详见图26(2)。
2、处理第二肝门 在肝脏顶部,沿中肝裂相当于肝中静脉走行部切开肝实质,深约2~3cm,分离出肝中静脉,于汇入下腔静脉入口下约1cm处将肝中静脉结扎、切断。在第2肝门处理肝中静脉,必须注意约有60%的肝中静脉与肝左静脉合干后汇入下腔静脉,要在合干前结扎肝中静脉,以免误伤肝左静脉。详见图25(6)。
3、切除肝中叶 将供应肝中叶的血管阻断以后,肝中叶区域颜色即变暗紫,界限明显。准备切除中肝叶之前可在第1肝门安放阻断带,以备必要时阻断第1肝门血流。在右叶间裂和左叶间裂的内侧各0.5~1cm处切开肝被膜,用钝性和锐性分离法,对准下腔静脉方向切开肝实质。在肝断面上的小血管与胆管分支要逐一钳夹、切断并作结扎或缝扎。在靠近肝背侧面时要仔细分离下腔静脉前壁,遇到肝短静脉支要牢固结扎、切断,处理肝短静脉前必须在肝后显露下腔静脉。在切断肝中叶过程中,注意切勿损伤左外叶及右后叶应保留的主要管道结构。详见图26(4)(5)。
4、处理肝断面 肝中叶切除后,形成一上宽下窄的楔形残腔。两侧肝断面仔细止血后,小儿肝脏柔软,多可缝合并拢。肝断面区及网膜孔附近置引流后,关腹完成手术。详见图26(6)。
(四)肝右三叶切除术
这一术式切除肝左外叶以外的全部肝组织,即右半肝加左内叶,占整个肝脏体积的80~85%。肝右三叶切除包括Couinaud分类的Ⅳ、Ⅴ、Ⅵ、Ⅶ、Ⅷ段,有时需包括Ⅰ段的右侧小部分。有肝硬变者不能采用此手术。
【手术切口】
体位、切口同右半肝切除术。宜取“人”字形偏右的的切口暴露好切更易操作。
【手术步骤】
显露第1、2肝门及处理肝后下腔静脉及肝短静脉步骤与右半肝切除大致相同。现对其不同点加以描述。
(1)第1肝门显露(2)第2肝门显露后,结扎肝中静脉(3)切断肝短动脉(4)分离肝实质(5)以镰状韧带覆盖肝切面

图27:肝右三叶切除术示意图
1、处理第一肝门 按右半肝方法切断结扎胆囊管、右肝管、右肝动脉及门静脉右干后,继续解剖分离出并保留肝门左侧管道结构。在肝门左侧结构中分离并结扎通向左内叶的胆管、肝动脉及门静脉分支。详见图27(1)。
2、处理第二肝门 在膈下下腔静脉处解剖出肝右静脉及肝中静脉,在该二条静脉汇入下腔静脉前0.5~1cm处结扎切断。尤其要注意肝中静脉与肝左静脉合干的问题,因此必须在汇入肝左静脉前结扎切断肝中静脉,而完好保留肝左静脉。一旦肝左静脉同时被误扎损伤,将导致Budd-Chiari综合症的致命后果。详见图27(2)(3)。
3、切除肝脏 在处理、切断汇入肝后下腔静脉的数支肝短静脉后,分离肝脏与下腔静脉的纤维粘连,使肝脏与后方的下腔静脉完全分离。最后在镰状韧带右侧约1cm处切开肝被膜。用钝性及锐性分离的方法分离肝实质,遇到管索结构时应予结扎、切断。最后切除右侧半肝和左内叶肝脏。详见图27(4)。
4、缝合肝断面 将肝断面小血管或小胆管缝扎止血,再用褥式或连锁缝合后,把镰状韧带覆盖粗糙面。详见图27(5)。
5、残肝处理 术毕要把残肝冠状韧带及三角韧带与膈肌缝合固定,以免残肝叶扭曲,影响血液回流。其他注意事项同右半肝切除术。
(五)不规则性部分肝切除术
部分肝切除术(Partial hepatectomy) 原先用于瘤体较小、位于肝边缘区的病变。近年常用于较复杂的病例,手术时不按肝叶、段的解剖范围、而是以肿瘤为中心切肝,仍能达到完全切除病灶的目的,称为根治性部分肝切除术。
【手术切口】
体位、切口同右半肝切除术。
【手术步骤】
1、根据肿瘤的部位与大小,游离肝周韧带。以小儿常见的肝右叶肿瘤切除为例,分离右三角韧带、部分右冠状韧带、肝肾和肝结肠韧带,必要时切断数根肝短静脉,使右叶下部充分游离。用一根乳胶管通过网膜孔束紧肝十二指肠韧带,阻断第一肝门(即Pringle手法)。
2、术者左手托住病变部位,右手用电刀在肝表面距肿瘤边界1~2ccm(最好2cm)处切开肝包膜和浅表肝实质。切口呈弧形或略显倒V形。
3、用指压法或刀柄分离肝实质,显露出肝实质内脉管,逐一钳夹、切断。近心断予结扎或加缝扎。如此边分离肝组织、边切断,结扎血管和胆管,直至切下肝肿瘤。可用大号脑吸引管边吸除已游离的肝实质碎块与积血,边作钝性分离暴露脉管,具有术野清晰的优点。
4、放开肝门阻断,出血点用细丝线作8字缝扎,用热盐水纱布敷压肝断面数分钟,仔细复查有无残留的出血或胆瘘。肝门阻断时间一般不超过20分钟。如需阻断更长时间,可用分次阻断法,阻断间歇为5分钟。
5、止血完全后,用温盐水冲洗术野。肝断面宜尽量闭合,采用肝针、可吸收缝线在距切缘1.5cm处作间断全层缝合。肝断面缝合后,止血较完善,且不留死腔。如缝闭有困难,亦可用一片带蒂或游离大网膜覆盖肝断面。
(6)肝断面下或膈下放置烟卷、乳胶管或双套管引流,经戳孔引出腹腔。
( 董 蒨 )
参考文献
1.唐力军,张再重,王瑜等.小儿肝间叶性错构瘤诊断和治疗.中华小儿外科杂志,2009,30(3):168-172
2.董蒨,江布先,张虹等.螺旋CT三维成像在小儿巨大及复杂部位肝脏肿瘤诊治中的应用.中华小儿外科杂志,2006,27(1):6-9
3.王永刚,刘文英,唐耘熳等.小儿肝脏间叶性错构瘤的临床特点.肝胆外科杂志,2003,11(3):170-172
4.邓鸿雁,宋雪松.小儿肝细胞腺瘤1例.肝胆胰外科杂志,2005,17(4):267-267
5.金恺濂,吕志新,杨连海.肝脂肪瘤性肿瘤.中华放射学杂志,1995,29:419~420
6.李白莉,孙晓毅,余东海等.小儿肝脏巨大良性肿瘤及肿瘤样病变[J].肝胆外科杂志,2009,17(3):175-179
7.江正辉,黄志强.肝癌.重庆:重庆出版社,1996:251
8.黄志强. 肝脏外科手术学. 北京: 人民军医出版社, 1996
9.张金哲. 张金哲小儿外科学. 北京: 人民卫生出版社, 2013
10.苏英豪,朱世能,陆世伦等.肝细胞癌组织中HCV基因型的逆转录原位PCR检测[J].世界华人消化杂志,2000,8(8):874-878
11.陈明易,黄志强,陈乐真等.原位PCR检测肝外胆管癌组织内的丙型肝炎病毒RNA及其意义[J].中华外科杂志,2001,39(2):165
12.刘重阳,刘为纹,杨建民等.丙型肝炎病毒核心蛋白激活肝癌细胞血管内皮生长因子的表达[J].中华肝脏病杂志,2001,9(4):214-216
13.尤俊,林小军,张亚奇等.肝脏炎性假瘤的诊断和治疗[J].中华肝胆外科杂志,2002,8(3):162-165
14.王宝恩,贾继东,主译.肝胆疾病的命名规范、诊断要点及预后. 北京:人民卫生出版社, 1997, 191
15.苏英姿,袁新宇,白凤森等.儿童实性肝脏间叶性错构瘤的超声特征与临床病理研究[J].中华小儿外科杂志,2013,34(1):14-18
16.钟麟, 张秀辉, 郎诗民,等. 小儿肝母细胞瘤的临床病理特点及预后. 实用肿瘤杂志 2000, 15: 102-104
17.李佩娟主编.小儿肿瘤病理学 北京 北京出版社.2000
18.肖梦,梁长虹,刘再毅等.肝脏炎性假瘤的影像表现与病理对照分析[J].医学影像学杂志,2015,(4):653-656,657
19.段恕诚, 董永绥, 朱启容. 主编 小儿肝胆系统疾病 人民卫生出版社 2002年 北京 463-466, 473-476
20.中华医学会外科学分会肝脏外科学组.肝脏解剖和肝切除手术命名以及肝血流阻断方法与选择原则[J].中华外科杂志,2010,48(3):196-200
21.沈柏用,施源.肝脏分段解剖的新认识[J].世界华人消化杂志,2008,16(9):913-918
22.董蒨 小儿肝脏肿瘤.董蒨主编 《小儿肝胆外科学》, 人民卫生出版社 2005年1月第一版 北京 P225~274
23.董蒨. 小儿肿瘤外科学[M]. 北京: 人民卫生出版社,2009. 523-525.
24.董蒨,陈永健,卢云,等.数字医学与计算机辅助手术的发展及临床应用[J]. 中国信息界-e医疗,2013,(9):58-61.
25.[11] 周显军,苏琳,董蒨, 等. 计算机辅助手术系统在小儿复杂性肝脏肿瘤精准手术中的应用[J]. 中华小儿外科杂志, 2015, 36(4):244-248.
26.[12] 董蒨,王宝磊. 小儿肝脏肿瘤的诊治挑战和计算机辅助肝切除手术[J]. 临床外科杂志, 2013, 21(8):585-587
27.奥田邦雄[日],K.G.伊莎克[美]主编,杨榕,等译.肝脏肿瘤.上海:上海科学技术出版社.1991:121
28.Shehata BM, Gupta NA, Katzenstein HM, et al.Undifferentiated embryonal sarcoma of the liver is associated with mesenchymal hamartoma and multiple chromosomal abnormalities: a review of eleven cases.Pediatr Dev Pathol. 2011 Mar-Apr;14(2):111-116
29.Sugito K, Kawashima H, Uekusa S,et al. Mesenchymal hamartoma of the liver originating in the caudate lobe with t(11;19)(q13;q13.4): report of a case. Surg Today. 2010;40(1):83-87.
30.Seki S, Kitada T, Sakaguchi H, et al. A clinicopathological study of inflammatory pseudotumors of the liver with special reference to vessels.Hepatogastroenterology. 2004 Jul-Aug;51(58):1140-1143
31.Hamzaoui L, Medhioub M, Mahmoudi M, et al. Inflammatory pseudotumor of the liver. Presse Med. 2016 Sep;45(9):804-807
32.Wildhaber BE, Montaruli E, Guérin F, et al. Mesenchymal hamartoma or embryonal sarcoma of the liver in childhood: a difficult diagnosis before complete surgical excision. J Pediatr Surg. 2014 Sep;49(9):1372-1377
33.Qureshi SS, Bhagat M, Kembhavi S, et al. Benign liver tumors in children: outcomes after resection. Pediatr Surg Int. 2015 Dec;31(12):1145-1149
34.Gasljevic G, Lamovec J, Jancar J. Undifferentiated (embryonal) liver sarcoma: synchronous and metachronous occurrence with neoplasms other than mesenchymal liver hamartoma. Ann Diagn Pathol. 2011 Aug;15(4):250-256
35.Greenberg M, Filler R M, hepatic turmors. In Principle and Practice of Pediatric Oncology Edited by Pizzo P A, Poplack D G Lippicott-Raven Publishers, Philadelphia· New York, 1997, P 717-732
36.Wiegering VA, Klein I, Wirth C, et al. Anemia and B Symptoms as Leading Symptoms for a Hepatic Inflammatory Pseudotumor--2 Case Reports. Klin Padiatr. 2015 Nov;227(6-7):363-365
37.Sakai M, Ikeda H, Suzuki N, et al, Inflammatory pseudotumor of the liver: case report and review of the literature. : J Pediatr Surg. 2001 ;36(4):663-666
38.Rosito P, Mancini AF, Semeraro M, et al. Malignant primary tumors of the liver in childhood. Pediatr Med Chir. 2002, 24:200-207.
39.Tang S, Chan CP, Ng PW. The many facets of presentation of hepatocellular carcinoma.
N Z Med J. 2003 20;116:489.
40.Yokota T, Suda T, Igarashi M, Telomere length variation and maintenance in hepatocarcinogenesis.
Cancer. 2003 98:110-8.
41.Bouyn CI, Leclere J, Raimondo G, Hepatic focal nodular hyperplasia in children previously treated for a solid tumor. Incidence, risk factors, and outcome.
Cancer. 2003 97:3107-3113
42.Kondo F. Is there a common cause of adenoma, focal nodular hyperplasia, and hemangioma of the liver? J Gastroenterol Hepatol. 2003 18:357-358.
43.Koea JB, Broadhurst GW, Rodgers MS, Inflammatory pseudotumor of the liver: demographics, diagnosis, and the case for nonoperative management.
J Am Coll Surg. 2003 196:226-235.
44.Hamada Y, Takada K, Fukunaga S, Hioki K. Hepatoblastoma associated with Beckwith-Wiedemann syndrome and hemihypertrophy.
Pediatr Surg Int. 2003 19:112-114.
45.Shim YH, Park HJ, Choi MS, Kim JS, Kim H, Kim JJ, Jang JJ, Yu E. Hypermethylation of the p16 Gene and Lack of p16 Expression in Hepatoblastoma.
Mod Pathol. 2003;16:430-436.
46.Matsunaga T, Sasaki F, Ohira M, et al. Analysis of treatment outcome for children with recurrent or metastatic hepatoblastoma. Pediatr Surg Int 2003 , 19:112-114
47.Qian Dong, Wenjian Xu, Buxian Jiang, et al: Clinical applications of computerized tomography 3-D reconstruction imaging for diagnosis and surgery in children with large liver tumors or tumors at the hepatic hilum. Pediatr Surg Int , 2007, 23(11): 1045-1050
48.Meyers RL.Tumors of the liver in children. Surg Oncol. 2007 ;16(3):195-203.
49.Sorge I, Bierbach U, Finke R, Hirsch W. Multiple malignant and benign lesions in the liver in a child with adrenocortical carcinoma. Pediatr Radiol. 2008;38(5):588-591.
50.Anil G, Fortier M, Low Y. Cystic hepatic mesenchymal hamartoma: the role of radiology in diagnosis and perioperative management.The British journal of radiology 2011;84:e91-4.
51.Chang HJ1, Jin SY, Park C, et a1. Mesenchymal hamartomas of the liver: comparison of clinicopathologic features between cystic and solid forms[J].J Korean Med Sci. 2006 Feb;21(1):63-8.
52.[10] Oshiro Y, Yano H, Mitani J, et a1. Novel 3-dimensional virtual hepatectomy simulation combined with real-time deformation. World J Gastroenterol. 2015 Sep 14;21(34):9982-92.
53.藤沢知雄、友政 剛 編集 小児消化器肝臓病マニュアル 診断と治療社 日本 東京 2003 311―314

.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)